
2.该月份限制甲、乙、丙、丁四地农业发展的主要因素,
正确的是w.w.^w.k.&s.5*
A.甲地-洪涝灾害
B.乙地-干旱少雨
C.丙地-水源不足
D.丁地-光照不足
1.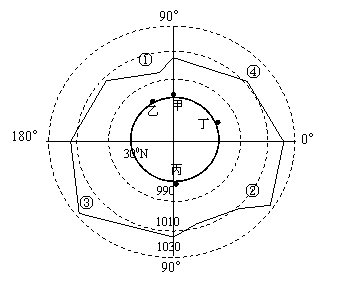 图中①②③④四点中,属于夏威夷高压的是
图中①②③④四点中,属于夏威夷高压的是
A.① B.② C.③ D.④
3. 本卷共 35 小题,每小题 4 分,共 140 分。
下图为7月底北纬30°附近海平面气压分布折线图(单位百帕),读图回答1-3题。
2. 做选择题时,如需改动,请用橡皮将原做题擦干净,再涂选其它答案标号。
15、学校课外活动小组为了测定某钢铁厂生铁样品中铁的质量分数,在实验室称取生铁样品5.8g放入烧杯中(烧杯的质量为30g)。然后再加入50g稀硫酸,使之充分反应后,称量,烧杯及烧杯中物质的总质量为85.6g(已知该反应中稀硫酸恰好反应完,杂质不参与反应)。请计算:
(1)产生氢气的质量是多少?
(2)该生铁样品中铁的质量分数?(精确到0.1%)
(3)反应后的溶液中溶质的质量分数?(精确到0.1%)
[解析]由于产生的氢气是气体,根据质量守恒定律,反应前后减少的质量就是生成的氢气的质量,所以求得氢气的质量为0.2g;根据氢气的质量,利用化学方程式可以求出样品中铁的质量和生成的FeSO4的质量,则可以得出结果。
[答案](1)产生氢气的质量是5.8+30+50-85.6=0.2g
(2)解:设生铁样品中铁的质量为x,生成FeSO4的质量为y
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.2g
解得x=5.6g y=15.2g
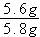
生铁样品中铁的质量分数为 ×100% = 96.6%
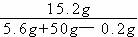 (3)反应后溶液中溶质的质量分数为
×100% = 27.4%
(3)反应后溶液中溶质的质量分数为
×100% = 27.4%
14、京京同学对金属活动性顺序等知识进行了研究。
(1)根据右图中的实验现象判断,稀盐酸里的A、B、C、D四种金属中,在金属活动性顺序里,位于氢后面的金属是(填字母) 。
(2)将甲、乙两种金属片分别放入硫酸铜溶液中,乙表面析出红色固体,甲没有明显现象。判断甲、乙、铜三种金属的活动性
由强到弱的顺序为 。
(3)查阅资料:金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原.在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法。

(4)查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2O
 反应生成的NO是无色、难溶于水的气体,在常温下与空气中的O2迅速化合生成NO2,NO2是红棕色、有刺激性气味的有毒气体。
反应生成的NO是无色、难溶于水的气体,在常温下与空气中的O2迅速化合生成NO2,NO2是红棕色、有刺激性气味的有毒气体。
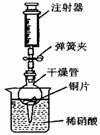
用右图所示实验装置进行实验,可以证明铜与稀硝酸反应生成的气体是NO。
①检查装置的气密性:关闭弹簧夹,将干燥管放人带有水的烧杯中,若观察到 ,则表明该装置的气密性良好。
②按右图所示进行实验:打开弹簧夹,用注射器慢慢抽取干燥管内的气体,稀硝酸沿着干燥管慢慢上升,直到 ,停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象: 。反应停止后,打开弹簧夹,用注射器抽取千燥管内的气体(事先已将注射器内原有的气体推出),关闭弹簧夹后取下注射器,并抽取一定量的空气,观察到气体变为红棕色。
③上述实验完成后,用足量NaOH溶液将气体吸收,其目的是
④下图是NO2气体和空气混合的实验示意图,观察图中A、B、D的表示方法,在C处画出相应的气体组成的粒子示意图。
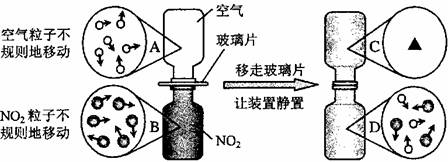
[解析]从图中可以看出金属D与酸不反应,所以排在氢后面的金属是D;乙表面析出红色固体,说明乙能置换出铜,则乙比铜活泼,甲没有明显现象,说明甲在金属活动性顺序中排在铜的后面,不能置换中硫酸铜中的铜;从图4-12中可以看出,如果液面进入干燥管中,则气密性不好,实验开始,为了让硝酸与铜接触,必须用注射器慢慢抽取干燥管内的气体,让稀硝酸在大气压强的作用下进入干燥管,由于NO2能够污染空气所以必须用NaOH溶液除掉;当与空气混合静置后,彼此分子互相混合已经比较均匀,所以D处与C处的气体组成的粒子情况是相同的。
[答案](1)D
(2)乙>Cu>甲
(3)①2HgO===2Hg+O2 (合理答案均可)
②C+2CuO==2Cu+CO2(合理答案均可) ·
③用一种金属还原金属氧化物(合理答案均可)
(4)①若干燥管内的液(水)面比烧杯内的液(水)面低,且过一段时间后干燥管内的液 (水)面保持不变
②充满干燥管 铜片表面有气泡产生,铜片溶解,溶液由无色变成蓝色,液面下降
③防止污染空气
④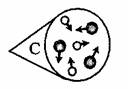
13、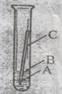 据有关资料报导,现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%-40%。小雄同学为探究铁的锈蚀条件,他将一支洁净的铁钉,放入置入空气中盛有少量水的试管中(如右图所示),一段时间后,发现铁钉
(填A或B或C)处最先出现铁锈。该实验说明,钢铁常温下接触
和
时容易生锈。
据有关资料报导,现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%-40%。小雄同学为探究铁的锈蚀条件,他将一支洁净的铁钉,放入置入空气中盛有少量水的试管中(如右图所示),一段时间后,发现铁钉
(填A或B或C)处最先出现铁锈。该实验说明,钢铁常温下接触
和
时容易生锈。
[解析]:A处与氧气接触,C处与水接触,B处与水和氧气接触,三者形成对比,说明铁生锈离不开水和氧气。
[答案]B;氧气(或空气);水
12、人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝。
(1)金属大规模被使用的先后顺序跟_____________(填序号)选项关系最大。
①地壳中金属元素的含量;②金属的导电性;③金属的活动性。
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质质量分数的足量稀盐酸中(反应中Mn显+2价),请回答:
|
金属 |
|
铁 |
|
锰 |
|
与盐酸反应现象 |
|
放出气泡速率缓慢 |
|
放出气泡速率较快 |
|
结论 |
|
活动性铁__________(填“>”“<”)锰 |
除了比较与酸反应产生气体速率的快慢,请你再举出一种可比较这二种金属活动性强弱的方法(写出所需药品即可):_____________和___________。
(3)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的镁和铁,待反应停止后,请判断:
①若天平仍保持平衡,烧杯中一定没有剩余的物质是____________;
②若天平失去平衡,则指针一定偏向放_____________的一边。
[解析]:金属的活动性越弱,就越容易被人类发现使用;(2)金属活动性越强,在与酸反应时产生氢气的速率就越快,把金属锰放入氯化亚铁中,置换出铁,则证明了锰比铁活泼;(3)天平保持平衡,说明产生氢气的质量相同,而产生相同质量的氢气所消耗的盐酸的质量相等,消耗掉的镁的质量比铁的质量少,如果酸有剩余,则产生氢气的质量不相等,所以烧杯中一定没有剩余的是稀盐酸;天平失去平衡,说明产生氢气的质量不相等,酸就有剩余,相同质量的镁比铁产生的氢气多,所以指针会偏向加入铁的一边。
[答案](1)③
(2)< 金属锰的薄片 氯化亚铁
(3)盐酸 铁
11、人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。请回答:
(1)地壳中含量最多的金属元素是
。
(2)根据下图4-2的应用实例,试说出金属具有的两点物理性质

 (3)早在春秋战国时期,我国古代人民已经开始炼铁。
(3)早在春秋战国时期,我国古代人民已经开始炼铁。
①写出磁铁矿(Fe3O4)与CO反应的化学方程式
。
②钢铁防腐十分重要!请写出一种防止钢铁生锈的方法
。
[解析]地壳中所含元素从多到少依次是氧、硅、铝、铁等所以地壳中含量最多的金属元素是铝;制造电线是利用了金属的导电性,制造金属丝是利用了金属的延展性和导电性等,制造炊具是利用金属的导热性及金属光泽等;炼铁的原理是3CO+ Fe2O3 高温 2Fe + 3CO2,防止铁制品生锈的方法是保持洁净、干燥的环境;涂一层保护膜如:刷漆、改变组织结构制成合金等。本题主要考查了金属的性质及防止生锈的方法。
[答案]
(1) Al (或铝)
 (2)导电性、延展性、导热性、金属光泽等
(2)导电性、延展性、导热性、金属光泽等
(3) ①Fe3O4+4CO 3 Fe+4CO2
②涂油、刷漆(或其它合理答案)
10、向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
A、Ag、Cu两种单质的混合物 B、Cu、Fe两种单质的混合物
C、Ag、Fe两种单质的混合物 D、Ag、Cu、 Fe三种单质的混合物
[解析]:解答此题的关键是题目中最后叙述的“向滤出的固体中滴加稀硫酸,有气体生成”这说明最终剩余的是铁。铁有剩余,又说明了AgNO3、Cu(NO3)2没有剩余,因为铁可以和AgNO3、Cu(NO3)2反应,Fe+ 2AgNO3=2Ag+Fe(NO3)2 Fe+Cu(NO3)2=Cu+Fe(NO3)2,所以原混合溶液中的AgNO3和Cu(NO3)2转化为了Ag和Cu,因此最终滤出的固体中含有Ag、Cu、 Fe。
[答案]D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com