
10.(1) (2分)
(2分)
(2)② (1分) 废弃物利用,有利于环保(合理即可)(2分)
(3)①减小 (1分) ②不变(1分) 有利 (1分)
(4)(答案合理即可,见右图1或图2)(3分)
(5)2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) △H=-1135.7kJ (4分)
10.(15分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
 ①2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
①2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
 ②2CO(g)+4 H2(g)
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
②2CO(g)+4 H2(g)
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
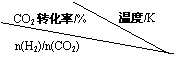 (3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
|
|
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2.0 |
60 |
43 |
28 |
15 |
|
3.0 |
83 |
62 |
37 |
22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
 ②提高氢碳比[n(H2)/n(CO2)],
K值 (填“增大”、“减小”、或“不变”),对生成乙醇
②提高氢碳比[n(H2)/n(CO2)],
K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
 已知:N2 (g)+2O2(g)===2NO2(g) △H=
+67.7kJ/mol
已知:N2 (g)+2O2(g)===2NO2(g) △H=
+67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= -534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
9.(16分)
(1)CH4 (g) + 2O2 (g) = 2H2O (l) + CO2(g) △H =-4Q kJ·mol-1 。……(2分)
(2)50-60均可,95%(填近似值即可) ………… (各2分,共4分)
(3)①40% …………(3分)
② ……(3分,无单位不扣分,写单位但写错扣1分)
……(3分,无单位不扣分,写单位但写错扣1分)
>……(1分) (4)CDE……(对1个给1分共3分,错、漏1个倒扣1分)
9.(16分)(1)已知4g甲烷气体充分燃烧生成CO 2(g)和H2O(l)时,放出Q kJ的热量.甲烷燃烧的热化学方程式为_____________________________________________.
(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中.反应方程式为H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
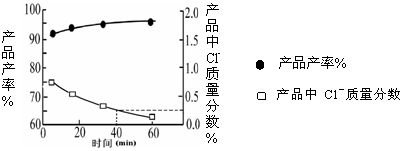
 由图中可知,当反应进行到约
min时,KDP晶体达到一级品标准,此时的产品产率约为
.
由图中可知,当反应进行到约
min时,KDP晶体达到一级品标准,此时的产品产率约为
.
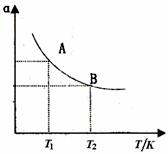
(3)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为 .
②在状态A时,平衡常数KA= (代入数值即可)当温度由T1变到T2时,KA KB(填“>”、“<”或“=”)
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)一样大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
8.(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:

(1)① I (2分) ② < ③ 80% (各2分)
(2) 442.8 kJ(3分)
(3)① O2 + 2H2O + 4e- = 4OH- (3分)
② 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O (3分)
7.(14分)(1)-246.1 kJ·mol-1(3分,未写单位扣1分);因为这些反应均为放热反应,随着反应的进行,反应器内温度必升高。而温度升高,化学平衡向左移动,同时,温度不断升高,催化剂的活性将降低,均不利于二甲醚的合成。(2分,只写出温度对平衡移动的影响而未指出温度对催化剂活性影响的扣1分)
(2)B、D(2分,错选1个扣1分)
(3)①正(2分),②CH3OCH3+3H2O-12e-=2CO2+12H+(3分,二甲醚写分子式不扣分),③7.2(2分)
7.(14分)DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
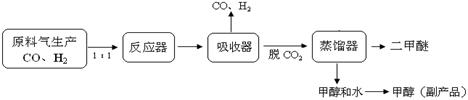
在一定的温度(230-2800C)、压强(2-10MPa)和催化剂作用下,反应器中进行下列一些反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.7kJ·mol-1
CH3OH(g) △H= -90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g)
△H= -23.5kJ·mol-1
CH3OCH3(g)+H2O(g)
△H= -23.5kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2(g)
△H= -41.2kJ·mol-1
CO2(g)+H2(g)
△H= -41.2kJ·mol-1
①反应器中总反应式可表示为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的△H = ▲ 。
CH3OCH3(g)+CO2(g),则该反应的△H = ▲ 。
②在生产过程中反应器必须要进行换热,以保证反应器的温度控制在230-2800C,其原因是 ▲ 。
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 ▲ 。
CH3OCH3(g)+3H2O(g)
△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 ▲ 。
A.容器中密度不变 B.容器内压强保持不变
C.v(CO2)︰v(H2)=1︰3 D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
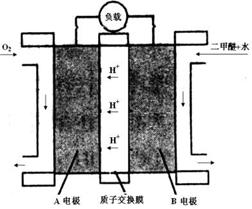 (3)右图为二甲醚燃料电池的工作原理示意图。请回答下列问题:
(3)右图为二甲醚燃料电池的工作原理示意图。请回答下列问题:
①A电极是 ▲ 极。
②B电极上发生的电极反应式是 ▲ 。
③若燃料电池中通入二甲醚(沸点为-24.9 ℃)的速率为1.12L/min(标准状况),以该燃料电池作为电源电解2 mol·L-1CuSO4溶液500mL,则通电30秒钟后理论上在阴极可析出金属铜 ▲ g(假设整个过程中,能量利用率为75%)。
6. (14分)(1)① 温度(1分) ② b (1分)
(2)① 0.13mol•(L•min) -1(2分) ② 放(1分) K=0.17(2分)
③ b=2a(1分),a>1(或使用合适的催化剂)(1分)
(3)c、d (2分)
(4)正 (1分) CH3 OH -6 e- + 8 OH- === CO32- + 6 H2O (2分)
6、(14分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
 C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 molH-O键
c. c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
6 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。(取小数二位,下同)
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K=_______.
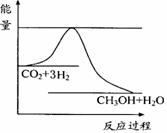 ③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是
(用含a、b的数学式表示)。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是
(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)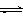 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(4)利用甲醇设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,采用铂或碳化钨作为电极催化剂。则通入氧气的电极应为 极(填写“正”或“负”), 放入甲醇的电极上发生的电极反应是
5.(13分)(1)8Al+3Fe3O44Al2O3+9Fe (2分)
(2)①煮沸 (1分)
②负 (1分) 生成白色沉淀 (1分)
Fe-2e-+2OH-===Fe(OH)2 ↓ (2分)
③4Fe(OH)2+O2+2H2O===4Fe(OH)3 (3分)
(3)FeaOb (3分)
[解析](1)R为Fe,Fe在X(O2)中燃烧生成甲(Fe3O4),Fe3O4在高温下与Al发生铝热反应生成Fe和Al2O3:8Al + 3Fe3O44Al2O3+ 9Fe。
(2)①由于Fe(OH)2易被O2氧化,所以配制NaCl、NaOH混合液中需通过加热煮沸的方法除去溶解在溶液中的O2。
②R与电源正极相连,失去电子产生Fe2+,所以石墨应连接电源的负极。Fe失去电子生成的Fe2+与溶液中的OH―反应生成白色的Fe(OH)2沉淀,其电极反应为:Fe-2e-+2OH―===Fe(OH)2↓。
③Fe(OH)2被空气中的O2氧化生成红褐色的Fe(OH)3:4Fe(OH)2+ O2+2H2O===4Fe(OH)3↓。
(3)R的氧化物与Al发生铝热反应后生成的Fe与盐酸反应产生H2(假设为a mol),等量的R的氧化物和Al粉混合物与NaOH溶液反应时,Al与NaOH溶液反应产生H2(假设为b mol)。根据Fe-H2,Al-1.5H2,Al-1.5O,可得R中含有a mol Fe,b mol O,故R的化学式为FeaOb。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com