
14.类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
A.①③④ B.①②⑤ C.③④ D.③④⑤
13.PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+。取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液。下列说法错误的是
A.充分振荡后静置,溶液颜色变为紫色
B.上述实验中不能用盐酸代替硫酸
C.若上述实验完全反应,消耗PbO2的物质的量为0.01mol
D.在酸性条件下,PbO2的氧化性比MnO4-的氧化性强
12.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。已知:2Fe2++Br2===2Fe3++2Br- 2Fe3++2I-===2Fe2++I2 则下列有关说法中,不正确的是
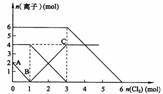 A.还原性:
A.还原性:
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
11.A、B、C、D、E 五种短周期元素,核电荷数依次增加。只有D为金属,A 与D 同主族,C与E同主族,B 原子最外层电子数是内层电子数的2 倍,D+与C3-具有相同的电子层结构。下列说法正确的是
A.C的氧化物都能跟碱反应
B.B的最高价氧化物的水化物是非电解质
C.C的氢化物与C的最高价氧化物的水化物能发生化合反应
D.沸点:CA3>EA3 离子半径:D+>C 3-
10.H2CO3和H2S在25℃时的电离常数如下:
|
电离常数 |
Ka1 |
Ka2 |
|
H2CO3 |
4.2×10-7 |
5.6×10-11 |
|
H2S |
5.7×10-8 |
1.2×10-15 |
则下列判断正确的是
A. NaHCO3+NaHS=Na2CO3+H2S反应可能发生
B. H2S+Na2CO3=NaHS+NaHCO3 反应不可能发生
C. 将Na2S溶液适当加热(忽略水的蒸发),溶液中阴离子数目会增多
D. Na2CO3溶液中:C(Na+)+C(H+)=C(CO32-)+ C(HCO3-)+C(OH-)
9.X、Y、Z、W是短周期元素,且核电荷数依次增大,并处在不同的四个主族,其中两种是金属元素。X原子最外层与次外层电子数相等.X与W、Y与Z这两对原子的最外层电子数之和相等,均为9;单质Y和W均可与NaOH溶液反应。下列说法中不正确的是
A.实验测知XW2熔点-107℃,沸点为12.5℃,说明XW2固态时为分子晶体
B.将YW3水溶液蒸发水分至干并灼烧可大量获得YW3的无水物
C.原子半径Y>Z>W
D.预测ZW2分子最有可能是极性分子
8.将17.9 gAl、Fe、Cu组成的合金溶于足量的:NaOH溶液中,产生气体3.36 L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72 LNO(标况),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为
A.33.2 g B.25.4 g C.22.4 g D.19.6 g
7. H2CO3和H2S在25℃时的电离常数如下:
|
电离常数 |
Ki1 |
Ki2 |
|
H2CO3 |
4.2×10-7 |
5.6×10-11 |
|
H2S |
5.7×10-8 |
1.2×10-15 |
则下列反应可能发生的是
A. NaHCO3+NaHS→Na2CO3+H2S B. H2S+Na2CO3→NaHS+NaHCO3
C. Na2S+H2O+CO2→NaHS+NaHCO3 D. H2S+NaHCO3→NaHS+H2CO3
6.下列实验装置设计正确,且能达到目的的是
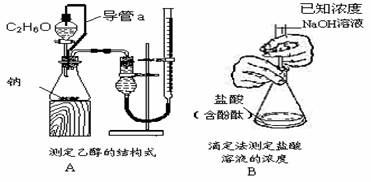
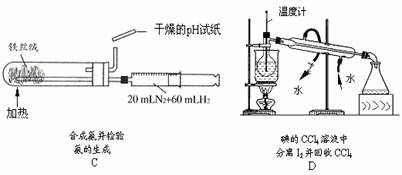
 不定项选择题:每题有1-2个正确选项
不定项选择题:每题有1-2个正确选项
5.将钠、二氧化碳的混合物12.9g投入到一定量水中,无固体剩余,溶液体积为100mL,共收集到标准状况下的气体VL。向反应后的溶液中逐滴加入浓度为2.00mol/L的盐酸50.00mL后开始有白色沉淀产生。下列叙述正确的是
A、原混合物中钠和二氧化碳的物质的量之比为2∶1
B、收集到的气体是氢气,V=3.36
C、加入盐酸之前溶液中溶质的物质的量均为0.1mol/L
D、原混合物中钠的质量为4.6g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com