
2.下列与人体内环境稳态调节有关的叙述,正确的是( A )
A.血浆中抗利尿激素随细胞外液渗透压升高而增多
B.人体维持体温相对稳定的调节方式为激素调节
C.当摄人食物过咸时将引起醛固酮的分泌量增加
D.胰岛素降低血糖浓度的原理是切断血糖的来源
1.下列关于稳态的叙述,错误的是(A)
A.稳态主要是机体通过消化、呼吸、循环系统共同维持的
B.正常情况下内环境的各项理化指标都在一定范围内波动
C.稳态的主要调节机制是神经-体液-免疫调节
D.体内多对缓冲物质对维持体液pH相对稳定具有重要作用
22.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)  CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其原因是 。
(2)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
ν正、ν逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
ν正=ν逆 |
|
Ⅱ |
0.12 |
0.20 |
________ |
ν正=ν逆 |
|
Ⅲ |
0.10 |
0.20 |
0.40 |
ν正____ν逆 |
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。
用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
② 50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
21.糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖 ( C6H12O6)。下列说法正确的是 ( 错选倒扣分 )
A.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇 [ CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后不会升高血糖。请预测木糖醇的一种化学性质 ( 写反应方程式 ):
(3)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物 A。A 的实验结果如下:
I、通过样品的质谱测得 A 的相对分子质量为 60
II、核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值 (信号),根据 峰值 (信号) 可以确定分子中氢原子的种类和数目。例如:乙醇 (CH3CH2OH) 有三种氢原子 (图1)。经测定,有机物 A 的核磁共振氢谱示意图如图2
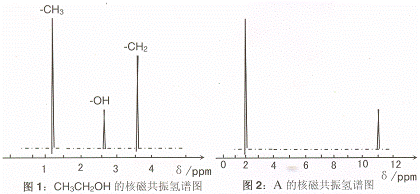
III、将 A 溶于水,滴入石器试液,发现溶液变红。
试推导写出 A 的结构简式为 。
(4)糖尿病人宜多吃蔬菜和豆类食品。蔬菜中富含纤维素,豆类食品中富含蛋白质。下列说法错误的是: (填序号,错选倒扣分)
A.蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
(5)香蕉属于高糖水果,糖尿病人不宜食用。乙烯是香蕉的催熟剂,可使澳的四氯化碳溶液褪色,试写出该反应的化学方程式:
20.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平方程式:口 Na2FeO2+ 口 NaNO2+ 口 = 口 NaFeO2+ 口 NH3↑+ 口 NaOH
 (2)钢铁的“钝化”处理也能达到防腐目的,经
(2)钢铁的“钝化”处理也能达到防腐目的,经
冷、浓 HNO3 处理后,其表面有一层致密氧化物保护膜,但是加热或在稀 HNO3中 就不能 “钝化”。
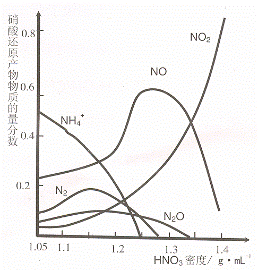
不同浓度的 HNO3 与铁反应的还原产物很复杂,
其分布曲线如图。
① 图示可知,密度为 1.05g·mL-1 的硝酸与铁
反应时,其最多的还原产物是 ;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:
。
② mg 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO, 则 m 的取值可能是 (填字母编号 )
A. B.
B. C.
C. D.
D. E.
E.
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
(3)金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
19.海波 (Na2S2O3•5H2O) 可用作脱氯剂、定影剂、解毒剂。硫粉和亚硫酸纳溶液煮沸可制得 Na2S2O3•5H2O;Na2S2O3•5H2O的部分性质见下表:
|
物理性质 |
易溶于水,不溶于乙醇;熔点 48.2℃;在潮湿的空气中易潮解 |
|
化学性质 |
43℃以上的空气中易风化;遇酸易分解 (S2O32―+2H+=S↓+SO2↑+H2O ) |
实验室制备海波过程如下:
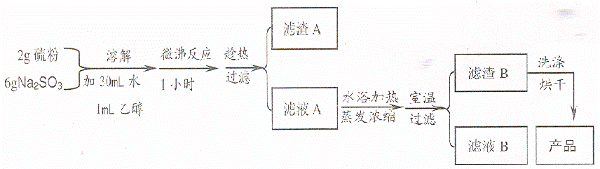
(1)实验开始时,加入1 mL C2H5OH 的目的是
(2)滤液 A 中除有Na2S2O3和少量 Na2SO3 外,最可能存在的无机化合物杂质是 , 如果滤液中该杂质的含量不很低,其检测的方法是
(3)过滤操作所用的玻璃仪器有 , 过滤后发现滤渣 B 中有少量淡黄色物质。为除去淡黄色物质,洗涤滤渣 B 的操作过程是
(4)烘干滤渣 B 时应注意什么问题 ,原因是
18.某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案如下:
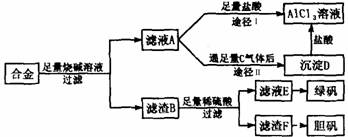
试回答下列问题:
(1)过滤用的玻璃仪器有 。
(2)写出滤液A转化为沉淀D的离子方程式 。
(3)由滤液A制AlCl3溶液的途径有Ⅰ和Ⅱ两条,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是
。
(4)从滤液E中得到绿矾晶体的实验操作是 。
(5)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 。
(6)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案 (填“合理”或“不合理”),理由是 。
17.重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
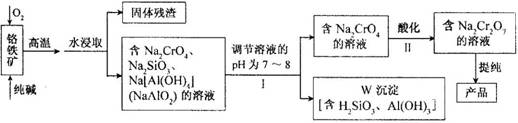
请回答下列问题。
⑴若Ⅰ中只用一种试剂调节溶液的pH,应选用 (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑵Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
(用离子方程式表示)。
⑶Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 氧化还原反应(填“是”或“不是”),反应的平衡常数表达式K= 。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Ag2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 。
16.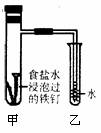 铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)钢铁的腐蚀
钢铁在潮湿的空气中被腐蚀的负极反应式为: ;将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,放入如下图所示装置中,下列叙述正确的是
A.过一段时间,乙试管中的导管内水柱上升
B.甲试管中铁钉发生了化学腐蚀
C.铁钉在该装置中被腐蚀的情况随时间的延长而加快
(2)生铁中含有一种铁碳化合物X( Fe3C)。 X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是: ;X与过量浓硝酸反应后溶液中含有的盐的化学式 。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
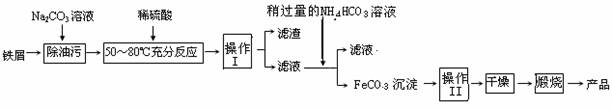
回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 ;
②Na2CO3溶液可以除油污,原因是(用离子方程式表示) ;
 ③请完成生成FeCO3沉淀的离子方程式:Fe2+ + HCO3- FeCO3↓+ + H2O
③请完成生成FeCO3沉淀的离子方程式:Fe2+ + HCO3- FeCO3↓+ + H2O
④写出在空气中煅烧FeCO3的化学方程式 ;
15.草酸晶体的组成可表示为:H2C2O4·xH2O,实验室常用其加热分解制取CO气体,反应的化学方程式为:H2C2O4·xH2O
 CO↑+CO2↑+(x+1)H2O,将生成的CO2和水蒸气除掉,即得到较纯净的CO气体。
CO↑+CO2↑+(x+1)H2O,将生成的CO2和水蒸气除掉,即得到较纯净的CO气体。
Ⅰ、下图是除去草酸分解产物中的CO2、水蒸气后得到CO,并用CO还原两通管中的CuO实验装置,回答下列问题。
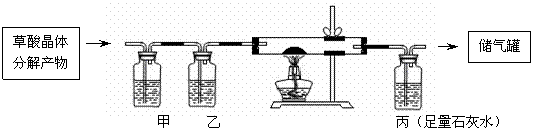
(1)在甲洗气瓶中所盛溶液是 ,在丙洗气瓶中观察到的现象是 。
(2)CuO全部被还原后停止实验操作的步骤的有:①停止通气体,②熄灭酒精灯,③拆下实验装置, ④继续通气体到两通管冷却止。其正确的操作顺序是 。
A.④②①③ B.①②③ C.②④①③ D.②④③
Ⅱ、为测定草酸晶体的x值,进行下列实验:
①取wg草酸晶体配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。滴定时,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验②中,滴定时,KMnO4溶液应装在 (填“酸式滴定管”、“碱式滴定管”)中。
(2)判断滴定终点的方法是 。若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是 。
(3)下列操作会引起测得的x值偏大的是 (填选项)
A.滴定结束时俯视读数
B.滴定结束后滴定管尖嘴处还有一滴标准液悬而未滴
C.锥形瓶未干燥即装入草酸溶液
D.滴定管用蒸馏水洗净后即装入KMnO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com