
3、将AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液中都会出现不同颜色的沉淀,沉淀的颜色变化是 _ __ ___ → _ _ _ __ → ___ __ _。出现这种颜色变化的原因是: _____
2、在2mL含有物质的量浓度相等的NaCl和NaI的混合溶液中滴入几滴AgNO3溶液,发生的反应为 ( )
A、只有AgCl沉淀生成 B、只有AgI沉淀生成
C、生成等物质的量的AgCl和AgI沉淀 D、两种沉淀都有,但以AgI为主
1、下列有关离子反应的叙述不正确的是 ( )
A、溶液中有难溶于水的沉淀生成是离子反应的发生条件之一
B、离子反应发生的方向总是向着溶液中离子浓度降低的方向进行
C、离子反应生成的沉淀的溶解度为0
D、生成沉淀的离子反应之所以能发生,在于生成物的溶解度更小
E、绝对不溶解的物质是不存在的
5、判断规则
通过比较溶度积与溶液中有关离子浓度幂的乘积(离子积)Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解。
Qc Ksp时: 溶液过饱和,平衡向生成沉淀的方向移动--有沉淀生成
Qc Ksp时: 溶液饱和,处于平衡状态
Qc Ksp时: 溶液不饱和,平衡向沉淀溶解的方向移动--沉淀溶解
[巩固练习]
4、影响Ksp的因素:温度
绝大数难溶盐的溶解是吸热过程,升高温度,向 移动。Ksp 。
少数盐的溶解是放热过程,升高温度,向生成 移动,Ksp 。如Ca(OH)2。
例题5:对于平衡AgCl(s)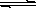 Ag+ + Cl-,若改变下列条件,对其平衡有何影响?
Ag+ + Cl-,若改变下列条件,对其平衡有何影响?
 条 件 |
平衡移动方向 |
C(Ag+) |
C(Cl-) |
Ksp |
溶解度(S) |
|
升高温度 |
|
|
|
|
|
|
加 水 |
|
|
|
|
|
|
加NaCl(s) |
|
|
|
|
|
|
加AgNO3(s) |
|
|
|
|
|
3、意义:溶度积Ksp反映了物质在水中的溶解能力。
溶度积和溶解度都可以表示物质的溶解能力,所以它们之间可以互相换算。知道溶解度可以求出溶度积,也可以由溶度积求溶解度。
例题4:25℃时,AgCl的溶解度是0.00192g·L-1,求它的溶度积。
2、表达式
MmNn(s) mMn+(aq)+nNm-(aq) Ksp =[c(Mn+])]m·c[(Nm-)]n
mMn+(aq)+nNm-(aq) Ksp =[c(Mn+])]m·c[(Nm-)]n
例如:AgCl(s)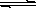 Ag+(aq)+ Cl-(aq) Ksp=c(Ag+)·c(Cl-)
Ag+(aq)+ Cl-(aq) Ksp=c(Ag+)·c(Cl-)
例题2:请写出下列物质的沉淀溶解平衡与溶度积KSP表达式。
Cu(OH)2
BaSO4
CaCO3
Al(OH)3
CuS
例题3:已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10,
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12,试求:
此温度下AgCl饱和溶液和Ag2CrO4饱和溶液中Ag+的物质的量浓度,并比较两者的大小。
1、概念:在一定温度下,难溶强电解质MmAn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,这时的离子浓度幂的乘积是一个常数,叫作溶度积常数,简称溶度积。符号为KSP
3、溶解平衡的建立:尽管AgCl溶解度很小,但并不是绝对不溶,生成的AgCl沉淀会有少量溶解。AgCl因此在生成AgCl沉淀后的溶液中三种有关反应的粒子在反应体系中共存。这样,生成沉淀的反应就转化成我们熟悉的固体溶解的问题。从固体溶解的角度来看,AgCl在水中存在两个过程:①在水分子的作用下,少量Ag+与Cl-脱离AgCl表面溶入水中,②溶液中的Ag+与Cl-受AgCl表面正、负离子的吸引,回到AgCl表面析出沉淀。在一定温度下,当沉淀溶液和生成的速率相等时,得到AgCl的饱和溶液,即建立下列平衡:
AgCl(s)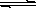 Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
正是这种平衡的存在,决定了Ag+与Cl-的反应不能进行到底。
(1)定义:在一定条件下,难溶强电解质溶于水,当沉淀溶解的速率和沉淀生成的速率相等时,形成溶质的饱和溶液,达到平衡状态,这种平衡称为沉淀溶解平衡。
思考1:将一块形状不规则的NaCl固体放入NaCl饱和溶液中,一昼夜后观察发现,固体变为规则的立方体,而质量却未发生变化,为什么?
(2)特征:(与化学平衡相比较)
① :可逆过程
② :v(溶解)= v(沉淀)
③ :达到平衡时,溶液中各离子浓度保持不变
④ :动态平衡,v(溶解)= v(沉淀) ≠ 0
⑤ :当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
(3)生成难溶电解质的离子反应的限度
不同电解质在水中的溶解度差别很大,例如AgCl和AgNO3。习惯上将溶解度小于0.01g的称为难溶电解质。对于常量的化学反应来说,0.01g是很小的,所以一般情况下,相当量的离子互相反应生成难溶电解质,就可以认为反应完全了。
化学上通常认为残留在溶液中的离子浓度小于 ,沉淀就达完全。
(4)影响沉淀溶解平衡的因素
(1)内因:
(2)外因:遵循 原理
①浓度:加水,平衡向 方向移动。
②温度:绝大数难溶盐的溶解是吸热过程,升高温度,多数平衡向 方向移动。
少数平衡向生成沉淀的方向移动,如Ca(OH)2的溶解平衡。
③同离子效应:向平衡体系中加入相同的离子,使平衡向 的方向移动。
例题1:将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为: _____
2、生成沉淀的离子反应之所以能发生,是因为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com