
23.(12分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关试验步骤和实验现象:
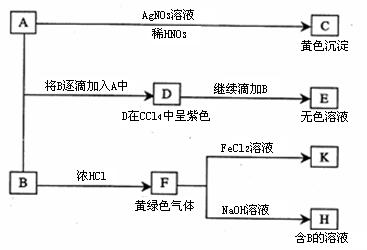
请回答:
(1)写出A、B和C的化学式:A__________,B___________,C____________
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
_____________________________________________________________________;
_____________________________________________________________________。
(3)写出由F→H的化学方程式:
_____________________________________________________________________。
22.(5分)过氧化钠几乎能与所有的常见气态非金属氧化物反应,如:2Na2O2+2CO2===2Na2CO3+O2, Na2O2+CO===Na2CO3。
(1) 试分别写出Na2O2与SO3、SO2反应的化学方程式:
_________________________________________________________ ;
_________________________________________________________ 。
(2)通过比较可知,当非金属元素处于 价时,其氧化物与Na2O2反应有O2生成。
21.(14分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置进行有关实验:
(1)先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
, ;
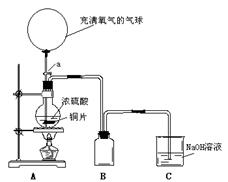 ②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
③实验结束后,装置C中的溶液中可能含有的溶质有 ;
(2)该小组的同学对浓硫酸的浓度小于什么值时就不和铜反应这个问题很感兴趣。为了获得这个知识,你认为他们可以采用的方法是 ;
(3)事实表明,上述反应全部结束后,硫酸仍有剩余。为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请你写出其中的一种
;
②乙学生设计的方案是:将反应后的溶液冷却后全部移入100mL容量瓶中并加蒸馏水定容,取20ml于锥形瓶中,用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量的浓度。你认为乙学生设计的实验方案能否准确求得余酸的物质的量的浓度 (填“能”或“否”),理由是 。
20.(11分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
⑴将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,使木条复燃 |
3.5分钟 |
|
块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2反应的化学方程式__________________________________。
②实验结果说明催化剂作用的大小与________________________有关。
⑵取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
|
双氧水体积 |
操作情况 |
反应完成所需的时间 |
收集到气体体积 |
反应后液体温度 |
|
a1%的150mL |
混合不振荡 |
11分钟 |
539mL |
24℃ |
|
a2%的15mL |
1分20秒 |
553mL |
56℃ |
|
|
a3%的7.5mL |
9秒 |
562mL |
67℃ |
请简要说明:
①反应完成所需的时间不同的原因___________________________________。
②反应后液体温度不同的原因_________________________ _____。
③收集到气体体积不同的原因 _____________________________________。
⑶向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式:____________________________。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)______________________________________________________ _______
________________________________________。
19、现有物质的量浓度为a mol·L-1的硫酸,其质量分数为W1;另有一物质的量浓度为b mol·L-1的硫酸,其质量分数为W2。若a=2b,则W1、W2的关系正确的是
A.W1=2W2 B.W1>2W2 C.W1<2W2 D.无法确定
18、R2O8n-离子在一定条件下可能把Mn2+离子氧化为MnO4-离子,若反应后R2O8n-离子变成RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-离子中n的值为
A.1 B.2 C.3 D.4
17、沼气是一种能源,其主要成分为CH4. 0.5molCH4完全燃烧生成CO2和H2O(液态)时,放出445kJ热量,则下列有关叙述中正确的有
A.热化方程式为:
2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=+890kJ·mol-1
B.热化方程式为:
2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=-890kJ·mol-1
C.CH4的燃烧热为890kJ
D.反应中如有CO生成,则释放的热将会减少
16、A、B、C三种元素的原子具有相同的电子层数,它们相同物质的量的原子获得相同物质的量的电子时释放出的能量是A>C>B,则它们的原子序数大小顺序是
A.B>C>A B.A>B>C
C.B<A<C D.A>C>B
9.在加热的条件下,氟气与等物质的量的烧碱反应,生成氟化钠、水和另一种气体物质,该气体物质的化学式是
A.H2 B.HF C.O2 D.OF2
10某温度下,100g饱和氯化钠溶液中含有氯化钠26.5g。若向此溶液中添加3.5g氯化钠和6.5g水,则所得溶液的溶质质量分数是
A.30%
B.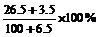
C.26.5%
D.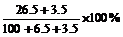
11在下列各分子中①NO2 ②BeCl2 ③H2O2 ⑤PCl5 ⑥N2 ⑦SCl2 ⑧BF3,所有原子都满足最外层8e-结构的组合是:
A.只有③⑥⑦ B.只有②③⑥
C.只有⑥⑦⑧ D.只有⑥⑦
12下列有关说法中不正确的是
A.磷酸为三元酸,H3AlO3为一元酸
B.分子中只有共价键的化合物一定是共价化合物
C.沸点:HF<HCl<HBr<HI
D.酸性:HClO4>H2SO4>H3PO4
13下列离子组在溶液中可能大量存在的是
A.Al3+、CH3C00—、Cl—、H+
B.Fe2+、Ba2+、K+、ClO-
C.Ba2+、Cl—、I—、NO3-
D.Na+、HCO3—、OH—、SO42-
14下列离子方程式中正确的是
A.硫化亚铁放入盐酸中 S2- + 2 H+ = H2S ↑
B.硫酸铜溶液中通入硫化氢 Cu2+ + H2S = CuS↓+ 2 H+
C.氯化铝溶液中加入过量氨水
Al3++4NH3•H2O=AlO2-+4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液
HCO3- + OH- = CO32- + H2O
15若短周期元素X、Y可形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是
A.1 B.3 C.5 D.6
8.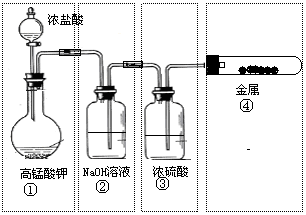 已知KMnO4与浓HCl在常温下反应能产生Cl2.若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应,每个虚线框表示一个单元装置,其中错误的是
已知KMnO4与浓HCl在常温下反应能产生Cl2.若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应,每个虚线框表示一个单元装置,其中错误的是
A. 只有①和②处 B.只有②处
C.只有②和③处 D.只有②、③、④处
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com