
36. (8分)[物理选修3-3]
(1) 蒸汽机、内燃机等热机以及电冰箱工作时都利用了气体状态变化来实现能量的转移和转化,我们把这些气体称为工质。某热机经过一个循环后,工质从高温热源吸热Q1,对外做功W,又对低温热源放热Q2,工质完全回复初始状态,内能没有变化。根据热力学第一定律,在工质的一个循环中,Q1、Q2、W三者之间满足的关系是 。热机的效率η=W Q1不可能达到100%,从能量转换的角度,说明 能不能完全转化为 能,而不引起任何变化。
(2) 某居民楼发生爆炸,造成多人受伤,事故原因被认定为使用煤气不当造成泄漏。一般情况下,煤气爆炸时房间内气体温度会从常温迅速升高到550℃,甚至更高。请你估算出发生爆炸时产生的气体的压强是大气压的多少倍?
35. (8分)[生物-现代生物科技专题]
克隆羊“多利”的问世引起了许多人对“治疗性克隆”的兴趣。下图所示为人类“治疗性克隆”的大概过程,请据图作答:
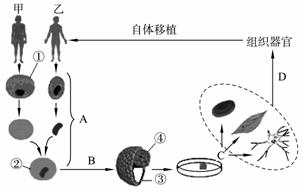
(1) 过程A表示 ,由此产生的重组细胞②的主要遗传物质来自图中的 。
(2) 图中B表示的生物技术名称是 ;C表示定向诱导技术,其诱导的对象是[ ] 细胞。
(3) 如果进行生殖性克隆,则不需要进行定向诱导,但必须进行 ,使得胚胎能正常发育成完整个体,该操作一般在 时期进行。
(4) 北京2008年奥运会之前,曾有人预测在本届奥运会上可能会出现“超级”运动员,即在基因组中增加了增强耐力和爆发力基因的运动员。这种操作一般选择 作为受体细胞,成功的标志是运动员体内 。
34. (8分)[生物-生物技术实践]
生物技术的广泛应用,不仅带来了较好的经济效益和社会效益,更使人们的生活变得更加丰富多彩。如普通洗衣粉已经逐渐被加酶、加香洗衣粉所替代;微生物发酵技术为我们制造了许多营养丰富的美味食品;植物色素的利用让食物变得更加温馨诱人;植物组织培养技术加快了优良品种的快速推广。请回答下列有关问题:
(1) 从自然界获得的微生物必须经过 才能应用于工业生产。果汁生产中常用的果胶酶广泛存在于植物果实和微生物中,工业上通常采用 等微生物发酵来生产果胶酶。
(2) 从微生物分离获得的酶通常需要检测 ,以便更好地将酶用于生产实践。目前使用的加酶洗衣粉都是一次性的,如果将酶固定在载体上,这些酶还可以被重复利用,这种方法制成的酶叫 。
(3) 将生物体内的酶进行分离可用凝胶电泳法,其原理是根据蛋白质分子的
来分离蛋白质。
(4) 高档洗衣粉中常加入一些由植物芳香油制成的香精,食品着色常使用从植物体内提取的植物色素。实验室常用 法提取植物色素。
(5) 有些农作物往往因为病毒积累导致产量降低,利用组织培养 技术培养可以获得不含病毒的脱毒苗。
(6) 利用微生物发酵的方法可以获得果酒、果醋。在果酒基础上酿制果醋的过程中,除需接种醋酸菌外,还必须保持 条件。
33. (8分)[化学-有机化学基础]
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
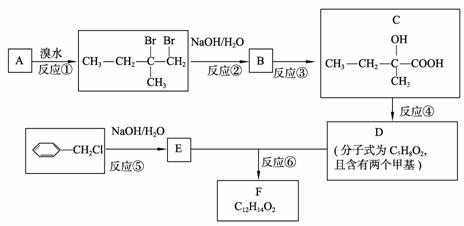
试回答下列问题:
(1) 若A物质与H2发生加成反应,产物的名称为 ;
C物质中含有的官能团名称是 ;
(2) 合成路线中反应③所属反应类型名称为 ;
(3) 反应④的化学方程式为 ;
(4) 按要求写出E的一种同分异构体的结构简式。
要求:① 属于芳香族化合物。② 遇浓溴水能产生白色沉淀。 。
32. (8分)[化学-物质结构与性质]
(1) 在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的中心离子微粒的电子排布式为 。已知SCN-呈线性结构,HSCN分子属于 (填“极性”或“非极性”)分子。
(2) 有两种活性反应中间体离子,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

(3) 某研究性学习小组的下列研究结论中,正确的是
;(填字母序号)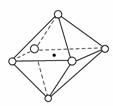
A. 两个原子之间只有在形成δ键之后才能形成π键,即不可能单独存在π键而无δ键
B. NaCl晶体结构中,Na+(小黑点)与Cl-(小白圈)的位置关系如右图所示
C. 同周期元素原子的第一电离能从左到右依次增大
(4) 取一定量的HF气体,分别在25℃、80℃、100℃时,测其相对分子质量分别为:58、20.6、20。温度不同时,测出的相对分子质量数值不同的原因是 。
31. (8分)[化学-化学与技术]
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示:
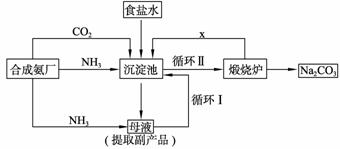
(1) 沉淀池中发生反应的化学方程式是 。
(2) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(3) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(4) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a. 增大NH4+的浓度,使 NH4Cl更多地析出
b. 使NaHCO3更多地析出
c. 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
30. (14分)化学实验是研究物质性质的基础。
(1) 下列有关实验操作或测量数据合理的是 (填序号)。
a. 用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b. 用干燥的pH试纸测定浓硫酸的pH
c. 用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2) 某废水样品中含有一定量的Na+、CO2-3、SO2-3,甲、乙两研究小组欲测定其中SO2-3离子的浓度。
甲组方案:废水100 mL试剂XSO2-4ⅰ加盐酸ⅱ加BaCl2溶液ⅲ系列操作固体称量计算

试剂X从下列试剂中选择:
a. 0.1 mol·L-1KMnO4(H2SO4酸化)溶液b. 0.5 mol·L-1NaOH溶液
c. 新制氯水d. KI溶液
① 加入试剂X后生成SO2-4的离子方程式为 ;
② 甲组方案中,第ⅲ步的“系列操作”包含的操作名称各为 ;
乙组方案:
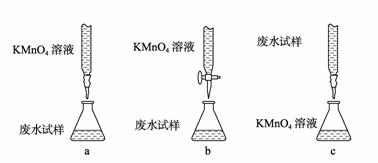
ⅰ. 用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ⅱ. 精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4(H2SO4酸化)溶液进行滴定;(有关反应为:2MnO-4+5SO2-3+6H-=2Mn2++5SO2-4+3H2O)
ⅲ. 记录数据,计算。
③ 乙组设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。
(3) 某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加1 mol·L-1的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 。
(4) 用下图装置进行CO2性质的有关实验。
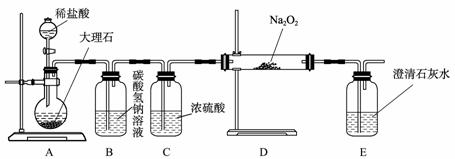
① 试剂瓶B中盛有饱和NaHCO3溶液,其目的是 ;
② 反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29. (16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1) 已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10 mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定(填序号)。
① 含Fe2+,不含Fe3+② 含Fe3+,不含Br-③ 含Fe3+,含有Br-
(2) 773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
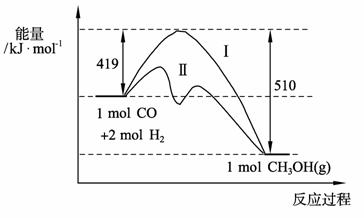
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ 下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g) CH3OH(g)ΔH>-91 kJ·mol-1
CH3OH(g)ΔH>-91 kJ·mol-1
 b. 使用催化剂, 能够提高反应物转化率
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
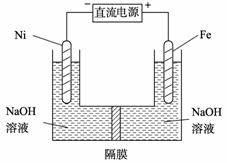
(3) 高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Fe电极作极 (填“阴”或“阳”);
② Ni电极的电极反应式
为: 。
(4) 氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:
NO-3+4H++3e-→NO+2H2O
① KMnO4、Na2CO3、CuO、KI四种物质中的 (填化学式)能使上述还原过程发生。
② 欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
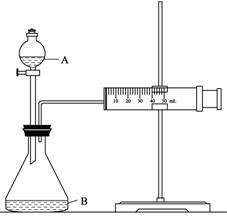
28. (12分)氮元素是生命活动、物质间转化的常见元素。
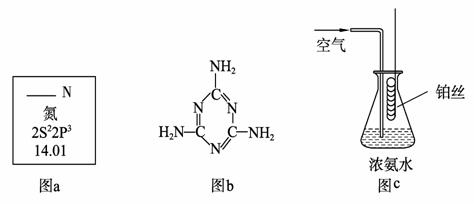
(1) 图a是元素周期表中N元素的有关信息,图a中横线上缺失的信息是 。15N是N元素的一种重要核素,其一个原子核中含有的中子数为 。
(2) “三鹿”奶粉中含有超标的三聚氰胺引起了人们对食品安全的极大关注。三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,正确的是 (填字母序号)。
a. 属于蛋白质b. 是氨基酸c. 是食品添加剂d. 和氨基酸含有相同种类的原子团e. 属于高分子化合物
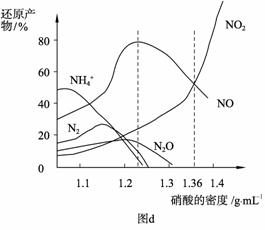 (3) 如上图c装置,将灼热的铂丝伸入锥形瓶中,同时通过导管鼓入空气,发现在锥形瓶口有少量的红棕色气体生成。写出导致该现象的主要化学方程式:
、
(3) 如上图c装置,将灼热的铂丝伸入锥形瓶中,同时通过导管鼓入空气,发现在锥形瓶口有少量的红棕色气体生成。写出导致该现象的主要化学方程式:
、
。
(4) 金属与不同浓度的硝酸反应时,往往生成多种不同价态的还原产物。图d是各种不同密度的硝酸与铁反应时(相同温度)还原产物的分布图。
① 某硝酸试剂瓶的标签注明:密度1.26 g·mL-1,质量分数 50.0%;若取该试剂10 mL配成1 000 mL溶液,所得溶液的pH= 。
② 当硝酸溶液的密度为1.36 g·mL-1时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)
a. 2Fe+10HNO3=2Fe(NO3)3+NO↑+3NO2↑+5H2O
b. 4Fe+18HNO3=4Fe(NO3)3+3NO↑+3NO2↑+9H2O
c. 2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O
27. (17分)某研究小组用番茄进行光合作用和呼吸作用的实验,结合所给材料,回答相关问题。
实验一:探究单株番茄光合作用强度与种植密度的关系,结果如甲图所示。与M点相比,N点限制单株光合作用强度的外界因素是 、 。实验还发现,不仅单株番茄光合作用强度与种植密度呈负相关关系,番茄植株的生长也与种植密度呈负相关,番茄生长的调节方式是 ,与番茄果实发育关系最密切的是 ,环境温度降低时,该物质运输速度会 。
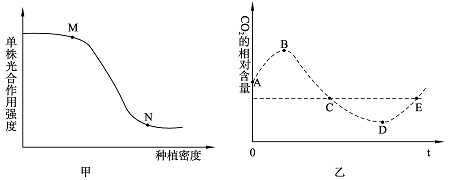
实验二:测量种植番茄的密闭大棚内一昼夜空气中的CO2含量变化,结果如乙图所示。B→C时间段,叶绿体内ADP的移动方向是 ,叶绿体内C3含量将 。图中表示番茄光合作用和呼吸作用强度相等的点是 。
实验三:采用“半叶法”对番茄叶片的光合作用强度进行测定,其原理是:将对称叶片的一部分(A)遮光,另一部分(B)不做处理,并采用适当的方法阻止两部分的物质和能量转移。在适宜光照下照射6小时后,在A、B的对应部位截取同等面积的叶片,烘干称重,分别记为MA、MB,获得相应数据,则可计算出该叶片的光合作用强度,其单位是mg/(dm2·h)
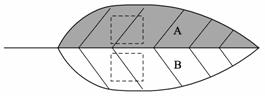
实验步骤如下:
(1) 请设计一张表格用于记录实验数据。(假设实验选定叶片数目为3)
(2) 若M=MB-MA,则M表示 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com