
2. Train the students’ reading ability.
Teaching Important Points:
1. Learn and master the words and expressions in the text:
2. Prepare the Reading part.
1. Read the article in Part A on page 102 in Workbook
2. Work in pairs and have a discussion about the questions below the pictures.
|
Sample answers 1 In my opinion, compared to the old city several years ago, my home town, Nanjing, is developing at a fast rate and is taking on a new look. As the capital city of east China’s Jiangsu Province, Nanjing has experienced great changes. Many buildings and motorways have been built, polluted rivers have been cleaned, and more trees and flowers have been planted. With the continued development of the city, there is no doubt that it will develop into a modern, international city in twenty years’ time. 2 I do not think giving food and money to poor people will solve all their problems. Food aid is merely a short-term solution to a long –term problem. Giving food and money will probably solve the immediate problem of hunger and food shortages, yet food has been eaten and the money has been used up. There are many causes of poverty. In order to solve the problem, we need to identify what causes poverty and then try to combat it. 3 As I see it, development brings both opportunities and challenges. Without correct policies and strategies, it may be bad for a country. To begin with, it might do harm to our natural environment. For example, many trees have been cut down in order to build factories, roads bridges. Besides, natural resources may be used up for development. |
Step3: Discussion:
Look at the following pictures and then have a discussion:
Food has never before existed in such abundance, so why are 820 million people in developing countries going hungry?
what causes poverty?
How to solve the problem?





|
For reference: the cause
of hunger wars diseases natural disasters local environment wrong policies and strategies growing population limited natural resources solution: stop wars give medical care and training improve local environment provide educational training donate food and money develop renewable energy |
|
For
reference: the cause of hunger 1. NATURE   Natural disasters such as
floods, tropical storms and long periods of drought are on the increase with
calamitous consequences for food security in poor, developing countries.
2. WAR
Since 1992, the proportion of short and long-term food crises that can be
attributed to human causes has more than doubled, rising from 15 percent to
more than 35 percent. All too often, these emergencies are triggered by conflict.
In war, food sometimes becomes a weapon. Soldiers will starve opponents into
submission by seizing or destroying food and livestock and systematically
wrecking local markets. Fields and water wells are often mined or contaminated,
forcing farmers to abandon their land.
3. POVERTY TRAP
In developing countries, farmers often cannot afford seed
to plant the crops that would provide for their families. Craftsmen lack the
means to pay for the tools to ply their trade. Others have no land or water
or education to lay the foundations
for a secure future. The poverty-stricken do not have enough money to buy or
produce enough food for themselves and their families. Natural disasters such as
floods, tropical storms and long periods of drought are on the increase with
calamitous consequences for food security in poor, developing countries.
2. WAR
Since 1992, the proportion of short and long-term food crises that can be
attributed to human causes has more than doubled, rising from 15 percent to
more than 35 percent. All too often, these emergencies are triggered by conflict.
In war, food sometimes becomes a weapon. Soldiers will starve opponents into
submission by seizing or destroying food and livestock and systematically
wrecking local markets. Fields and water wells are often mined or contaminated,
forcing farmers to abandon their land.
3. POVERTY TRAP
In developing countries, farmers often cannot afford seed
to plant the crops that would provide for their families. Craftsmen lack the
means to pay for the tools to ply their trade. Others have no land or water
or education to lay the foundations
for a secure future. The poverty-stricken do not have enough money to buy or
produce enough food for themselves and their families. In turn, they tend to be weaker and cannot produce enough to buy more food. In short, the poor are hungry and their hunger traps them in poverty.   4. R-EXPLOITATION OF
ENVIRONMENT
Poor farming practices, deforestation, overcropping and overgrazing are
exhausting the Earth's fertility and spreading the roots of hunger.
Increasingly, the world's fertile farmland is under threat from erosion,
salination and desertification. 4. R-EXPLOITATION OF
ENVIRONMENT
Poor farming practices, deforestation, overcropping and overgrazing are
exhausting the Earth's fertility and spreading the roots of hunger.
Increasingly, the world's fertile farmland is under threat from erosion,
salination and desertification. |
Step4: Homework:
Aims and requirements
◆ read an essay about food aid and development aid, and a feature story about sustainable development.
◆ listen to a conversation between a student and his grandfather about development
◆ discuss development and interview a government official
◆ write an essay about the development of your city or town
◆ prepare and present a report about how your city or town supports sustainable development
Procedures
● Welcome to the unit
Step 1 Brainstorming
 At the beginning of this period,
let’s watch a video. What can you learn from it?
At the beginning of this period,
let’s watch a video. What can you learn from it?
Step 2 Sharing information
1. Work in groups of four and discuss the four pictures on page 1.
Picture 1
 What is in the picture? (A
lot of grains and a hand.)
What is in the picture? (A
lot of grains and a hand.)
What can food aid do to help solve the problem of poverty? (Food aid can help feed people who have no food.)
Do you think food aid is a short-term or a long-term solution to the problem of poverty?
Why or why not? (Food aid is a short-term solution as it gives food immediately to people who are very hungry, but it does not allow them to grow their own food in the future.)
Picture 2
 What is the
man doing in the picture? (He is building something.)
What is the
man doing in the picture? (He is building something.)
Why do you think he works so hard? (He works so hard because he might be poor and need the money.)
Do you think training people to make a living is a short-term or long –term solution to the problem of poverty? Why or why not? (Training people is a long-term solution to the problem of poverty. It allows them to make a living by themselves.)
Picture 3
What has happened
to the village? (It has become a city. With the development of society, many
villages have changed a lot over the years. Tall buildings have been built and
motorways and bridges  have been constructed.
The living conditions of local people have been greatly improved. Small
villages have been developed into towns or cities.)
have been constructed.
The living conditions of local people have been greatly improved. Small
villages have been developed into towns or cities.)
 Do you prefer
living in the city or in the country? Why?
Do you prefer
living in the city or in the country? Why?
What problems may developing too fast cause? (Developing too fast might harm the natural environment. For example, many trees have been cut down in order to build factories, roads and bridges. Also, almost everything we do in our modern lives, be it cooking or traveling, requires the use of Earth’s natural resources, which we may run out of one day.)
Picture 4
 What do you think the things are used for? (I think these machines
are used to generate electricity by using wind power.)
What do you think the things are used for? (I think these machines
are used to generate electricity by using wind power.)
What might happen to the cold, oil and other natural resources in a thousand years? (The supplies of coal, oil
and other natural resources might run out in a thousand years.)
What is renewable energy? Can you suggest some good examples of energy for the future? (Renewable energy is energy that comes from a source that will not run out. Solar, wind and hydroelectric or water energy are all sources of renewable energy that could be used in the future.)
5、考查元素化合物知识不限考试说明中的11种元素,也不限熟悉物质的知识
 (广东)16. 磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
(广东)16. 磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
 A.H3PW12O40在该酯化反应中其催化作用
A.H3PW12O40在该酯化反应中其催化作用
 B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
 C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
 D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8
D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8
 [答案]D
[答案]D
(广东) 19.
19. 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。

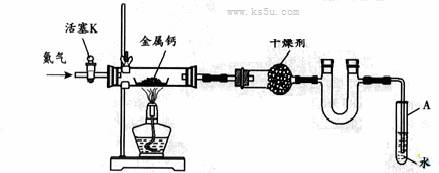

 (1)按图连接好实验装置。检查装置的气密性,方法是
。
(1)按图连接好实验装置。检查装置的气密性,方法是
。
 (2)反应过程中末端导管必须插入试管A的水中,目的是
。
(2)反应过程中末端导管必须插入试管A的水中,目的是
。
 (3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
 (4)数据记录如下:
(4)数据记录如下:


 ① 计算得到实验式CaxN2,其中x=
.
① 计算得到实验式CaxN2,其中x=
.
 ② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
 [答案](1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。
[答案](1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。
 (2)防止反应过程中空气进入反应管;便于观察N2的流速
(2)防止反应过程中空气进入反应管;便于观察N2的流速
 (3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。
(3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。
 (4)①2.80
(4)①2.80
②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2。若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3。
(广东) 21.
21. 三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。

 限选试剂:浓硫酸、1.0
mol·L-1HNO3、1.0
mol·L-1盐酸、1.0 mol·L-1
NaOH、3%
H2O2 、0.1mol·L-1KI、0.1
mol·L-1CuSO4、20%
KSCN、澄清石灰水、氧化铜、蒸馏水。
限选试剂:浓硫酸、1.0
mol·L-1HNO3、1.0
mol·L-1盐酸、1.0 mol·L-1
NaOH、3%
H2O2 、0.1mol·L-1KI、0.1
mol·L-1CuSO4、20%
KSCN、澄清石灰水、氧化铜、蒸馏水。
 (1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
 (2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是
,现象是
。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是
,现象是
。
 (3)固体产物中铁元素存在形式的探究。
(3)固体产物中铁元素存在形式的探究。
 ①提出合理假设
①提出合理假设
 假设1: ;
假设2:
;假设3:
。
假设1: ;
假设2:
;假设3:
。
 ②设计实验方案证明你的假设(不要在答题卡上作答)
②设计实验方案证明你的假设(不要在答题卡上作答)
 ③实验过程
③实验过程
 根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。


 [答案](1)CO2和CO
[答案](1)CO2和CO
 (2)利用焰色反应 透过蓝色钴玻璃,观察到紫色的火焰
(2)利用焰色反应 透过蓝色钴玻璃,观察到紫色的火焰
 (3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
(3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物与试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量硫酸铜溶液,再加入少量不溶固体,充分振荡 |
(1)
若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2)  若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在 若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2 ,充分振荡后滴加KSCN |
结合步骤2中的(2): (1)  若溶液基本无色,则假设1成立 若溶液基本无色,则假设1成立(2)  若溶液呈血红色,则假设3成立 若溶液呈血红色,则假设3成立 |
 (广东)
(广东) 22.
22. 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

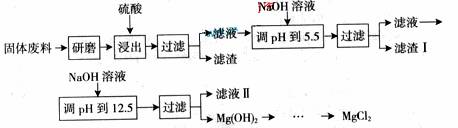
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
PH |
3.2 |
5.2 |
12.4 |
 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
 (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
 (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
 (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
 MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

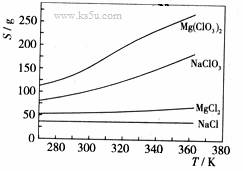
 ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
 ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
[答案](1)适当提高反应温度、增加浸出时间(或其他合理答案)
 (2)Fe(OH)3 Al(OH)3
(2)Fe(OH)3 Al(OH)3
 (3)Na2SO4
(3)Na2SO4
 (4)①在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
(4)①在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
 ② 降温前,溶液中NaCl已达饱和;降低过程中,NaCl溶解度会降低 ,会少量析出。重结晶。
② 降温前,溶液中NaCl已达饱和;降低过程中,NaCl溶解度会降低 ,会少量析出。重结晶。
(广东) 23.
23. 磷单质及其化合物的有广泛应用。
磷单质及其化合物的有广泛应用。
(1)
 由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
 4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)  H
H
 ①上述反应中,副产物矿渣可用来
。
①上述反应中,副产物矿渣可用来
。
 ②已知相同条件下:
②已知相同条件下:
 4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) 
 2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)

 SiO2(s)+CaO(s)=CaSiO3(s)
SiO2(s)+CaO(s)=CaSiO3(s)


 用
用 、
、 和
和 表示
表示 H
H ,
, H
H =
=
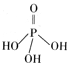
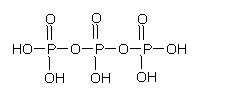
 (2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为

 (3)次磷酸钠(NaH2PO2)可用于化学镀镍。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
 ①NaH2PO2中P元素的化合价为
。
①NaH2PO2中P元素的化合价为
。
 ②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:

 (a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
(a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
 (b)6H2PO2- +2H+
= 2P+4H2PO3-+3H2↑
(b)6H2PO2- +2H+
= 2P+4H2PO3-+3H2↑
 请在答题卡上写出并配平反应式(a)。
请在答题卡上写出并配平反应式(a)。
 ③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
 方法上的不同点:
;原理上的不同点:
;化学镀的优点:
。
方法上的不同点:
;原理上的不同点:
;化学镀的优点:
。
 [答案]
[答案]
 ①生产水泥等建筑材料
①生产水泥等建筑材料
 ②
②  +3
+3 +18
+18
 (2)
(2)
 Na5P3O10
Na5P3O10
 (3)①+1
(3)①+1
 ② 1 Ni2+ + 1 H2PO2-+ 1 H2O → 1
Ni + 1 H2PO3- + 2H+
② 1 Ni2+ + 1 H2PO2-+ 1 H2O → 1
Ni + 1 H2PO3- + 2H+
 ③ 化学镀无需通电,而电镀需要通电
③ 化学镀无需通电,而电镀需要通电
 都利用氧化还原反应
都利用氧化还原反应
 化学镀对镀件的导电性无特殊要求
化学镀对镀件的导电性无特殊要求
(广东) 24.
24. 超细氧化铝是一种重要的功能陶瓷原料。
超细氧化铝是一种重要的功能陶瓷原料。
 (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。
 (2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
 ①用托盘天平称量NH4Al(SO4)2·12H2O固体
g;
①用托盘天平称量NH4Al(SO4)2·12H2O固体
g;
 ②将上述固体置于烧杯中
。
②将上述固体置于烧杯中
。
 (3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图

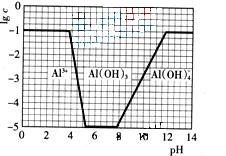
 ①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有
。
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有
。
 ②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
 [答案] (1)2NH4AlO(OH)HCO3
[答案] (1)2NH4AlO(OH)HCO3 Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑
 (2)①4.5g;②用量筒量取100mL水,搅拌溶解,用H2SO4调节溶液PH至2
(2)①4.5g;②用量筒量取100mL水,搅拌溶解,用H2SO4调节溶液PH至2
 (3)① H++OH-=H2O NH4++ OH-= NH3·H2O Al3++3OH-=Al(OH)3↓;
(3)① H++OH-=H2O NH4++ OH-= NH3·H2O Al3++3OH-=Al(OH)3↓;
 ②
②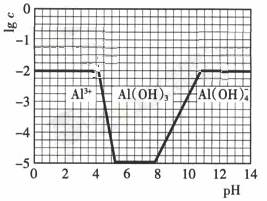
(海南) 15.
15. Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =
4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =
4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;

 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
答案(1)负极材料为Li(还原剂),Li – e- = Li+
(2)2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)出现白雾,有刺激性气体生成SOCl2 + H2O = SO2 ↑+ 2HCl↑
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
(江苏) 16.以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
16.以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

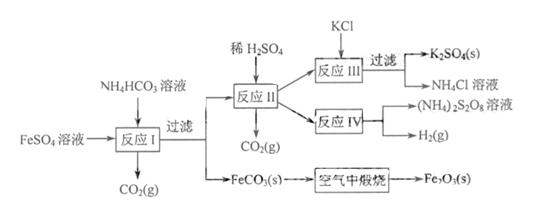
 (1)反应I前需在
(1)反应I前需在 溶液中加入 ▲
(填字母),以除去溶液中的
溶液中加入 ▲
(填字母),以除去溶液中的 。
。
 A.锌粉 B.铁屑 C.KI溶液 D.
A.锌粉 B.铁屑 C.KI溶液 D.
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (4)反应Ⅳ常被用于电解生产
(4)反应Ⅳ常被用于电解生产 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
 [标准答案](1)B
[标准答案](1)B
 (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4 的溶解度,有利于K2SO4 析出。
(3)降低K2SO4 的溶解度,有利于K2SO4 析出。
 (4)2SO42- -2e-
(4)2SO42- -2e- 2S2O82-
2S2O82-
 w
w (江苏)18.二氧化氯
(江苏)18.二氧化氯 是一种在水处理等方面有广泛应用的高效安全消毒剂。与
是一种在水处理等方面有广泛应用的高效安全消毒剂。与 相比,
相比, 不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
 (1)在
(1)在 的制备方法中,有下列两种制备方法:
的制备方法中,有下列两种制备方法:
 方法一:
方法一: ====
====
 方法二:
方法二: ====
====
 用方法二制备的
用方法二制备的 更适合用于饮用水的消毒,其主要原因是
。
更适合用于饮用水的消毒,其主要原因是
。
 (2)用
(2)用 处理过的饮用水(
处理过的饮用水( 为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子 .2001年我国卫生部规定,饮用水
.2001年我国卫生部规定,饮用水 的含量应不超过0.2
的含量应不超过0.2 。
。
 饮用水中
饮用水中 、
、 的含量可用连续碘量法进行测定。
的含量可用连续碘量法进行测定。 被
被 还原为
还原为 、
、 的转化率与溶液PH的关系如右图所示。当
的转化率与溶液PH的关系如右图所示。当 时,
时, 也能被
也能被

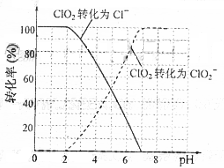 完全还原成
完全还原成 。反应生成的
。反应生成的 用标准
用标准 溶液滴定:
溶液滴定:

 ====
====
 ① 请写出
① 请写出 时,
时, 与
与 反应的离子方程式
。
反应的离子方程式
。
 ②请完成相应的实验步骤:
②请完成相应的实验步骤:
 步骤1:准确量取
步骤1:准确量取 水样加入到锥形瓶中。
水样加入到锥形瓶中。
 步骤2:调节水样的
步骤2:调节水样的 为7.0~8.0
为7.0~8.0
 步骤3:加入足量的
步骤3:加入足量的 晶体。
晶体。
 步骤4:加少量淀粉溶液,用
步骤4:加少量淀粉溶液,用

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 .
.

 步骤5: 。
步骤5: 。
 步骤6;再用
步骤6;再用

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
 ③根据上述分析数据,测得该引用水样中的
③根据上述分析数据,测得该引用水样中的 的浓度为
的浓度为  (用含字母的代数式表示)。
(用含字母的代数式表示)。
 ④若饮用水中
④若饮用水中 的含量超标,可向其中加入适量的,该反应的氧化产物是
(填化学式)
的含量超标,可向其中加入适量的,该反应的氧化产物是
(填化学式)
 [答案](1)方法二制备的ClO2中不含Cl2
[答案](1)方法二制备的ClO2中不含Cl2
 (2)①
(2)①
 ②调节溶液的
②调节溶液的
 ③
③
 ④
④

(安徽) 27.(12分)
27.(12分)
 某厂废水中含5.00×10-3mol·L-1的
某厂废水中含5.00×10-3mol·L-1的 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
( 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
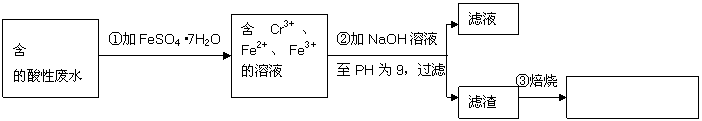






 (1)第①步反应的离子方程式是
(1)第①步反应的离子方程式是
 (2)第②步中用PH试纸测定溶液PH的操作是:
(2)第②步中用PH试纸测定溶液PH的操作是:

 (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
 (4)欲使1L该废水中的
(4)欲使1L该废水中的 完全转化为
完全转化为 。理论上需要加入
。理论上需要加入
 GFeSO4·7H2O。
GFeSO4·7H2O。
 答案:
答案:
 (1)Cr2O72- + 6Fe2+ + 14H+
(1)Cr2O72- + 6Fe2+ + 14H+  2Cr3+
+ 6Fe3+ + 7H2O
2Cr3+
+ 6Fe3+ + 7H2O
 (2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
 (3)Fe(OH)3、Fe(OH)2
(3)Fe(OH)3、Fe(OH)2

 (4)13.9
(4)13.9
(宁夏) 26.(14分)碱式碳酸铜可表示为:xCuCO3·yCu(OH)
2·zH2O,测定碱式碳酸铜组成的方法有多种。
26.(14分)碱式碳酸铜可表示为:xCuCO3·yCu(OH)
2·zH2O,测定碱式碳酸铜组成的方法有多种。
 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题:
 ①写出xCuCO3·yCu(OH)
2·zH2O与氢气反应的化学方程式
;
①写出xCuCO3·yCu(OH)
2·zH2O与氢气反应的化学方程式
;
 ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):

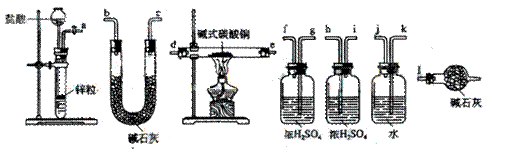 (a)→( )( )→( )(
)→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )(
)→( )( )→( )( )→( )( )→(l)







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
 (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。
 答案(1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H 2
= (x+y)Cu+ xCO2+(x+2y+z)H2O
答案(1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H 2
= (x+y)Cu+ xCO2+(x+2y+z)H2O
 ②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
 ③1.8 CuCO3·Cu(OH) 2·H2O
③1.8 CuCO3·Cu(OH) 2·H2O
 (2)可行 根据反应xCuCO3·yCu(OH) 2·zH2O=(x+y)CuO+
xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
(2)可行 根据反应xCuCO3·yCu(OH) 2·zH2O=(x+y)CuO+
xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
4、考查实际应用(生产、生活)能力知识
(广东) 22.
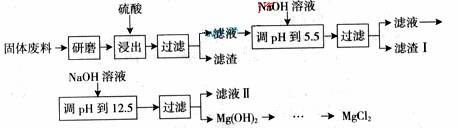
22. 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
PH |
3.2 |
5.2 |
12.4 |
 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
 (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
 (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
 (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
 MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

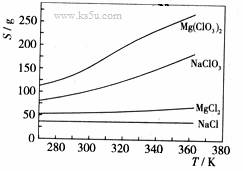
 ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
 ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
[答案](1)适当提高反应温度、增加浸出时间(或其他合理答案)
 (2)Fe(OH)3 Al(OH)3
(2)Fe(OH)3 Al(OH)3
 (3)Na2SO4
(3)Na2SO4
 (4)①在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
(4)①在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
 ② 降温前,溶液中NaCl已达饱和;降低过程中,NaCl溶解度会降低 ,会少量析出。重结晶。
② 降温前,溶液中NaCl已达饱和;降低过程中,NaCl溶解度会降低 ,会少量析出。重结晶。
(江苏) 16.以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
16.以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

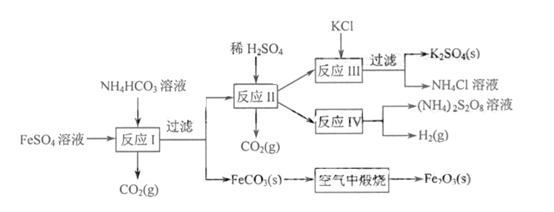
 (1)反应I前需在
(1)反应I前需在 溶液中加入 ▲
(填字母),以除去溶液中的
溶液中加入 ▲
(填字母),以除去溶液中的 。
。
 A.锌粉 B.铁屑 C.KI溶液 D.
A.锌粉 B.铁屑 C.KI溶液 D.
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (4)反应Ⅳ常被用于电解生产
(4)反应Ⅳ常被用于电解生产 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
 [答案](1)B
[答案](1)B
 (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4 的溶解度,有利于K2SO4 析出。
(3)降低K2SO4 的溶解度,有利于K2SO4 析出。
 (4)2SO42- -2e-
(4)2SO42- -2e- 2S2O82-
2S2O82-
 ((福建
((福建 )24.
)24.
 从铝土矿(主要成分是
从铝土矿(主要成分是 ,含
,含 、
、 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:

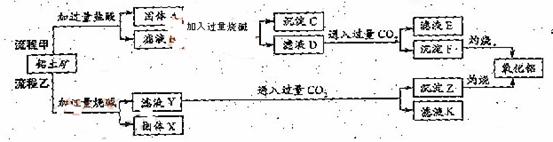
 请回答下列问题:
请回答下列问题:
 (1)流程甲加入盐酸后生成Al3+的方程式为_________.
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
 (2)流程乙加入烧碱后生成Si
(2)流程乙加入烧碱后生成Si 的离子方程式为________.
的离子方程式为________.
 (3)验证滤液B含
(3)验证滤液B含 ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
 (4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
 (5)已知298K时,
(5)已知298K时, 的容度积常数
的容度积常数 =5.6×
=5.6× ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的 =_______.
=_______.
 [答案]
[答案]
 (1)Al2O3 + 6H+
(1)Al2O3 + 6H+  2Al3+ +3H2O
2Al3+ +3H2O
 (2)SiO2 + 2OH-
(2)SiO2 + 2OH-  SiO32 - + H2O
SiO32 - + H2O
 (3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
 (4)NaHCO3;制纯碱或做发酵粉等合理答案
(4)NaHCO3;制纯碱或做发酵粉等合理答案
 (5)5.6×10-10mol/L
(5)5.6×10-10mol/L
3、考查化学实验能力知识
(广东) 19.
19. 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。

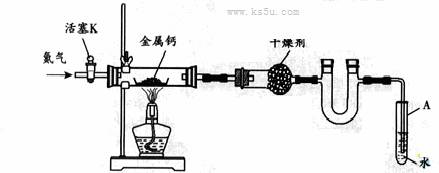

 (1)按图连接好实验装置。检查装置的气密性,方法是
。
(1)按图连接好实验装置。检查装置的气密性,方法是
。
 (2)反应过程中末端导管必须插入试管A的水中,目的是
。
(2)反应过程中末端导管必须插入试管A的水中,目的是
。
 (3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
 (4)数据记录如下:
(4)数据记录如下:


 ① 计算得到实验式CaxN2,其中x=
.
① 计算得到实验式CaxN2,其中x=
.
 ② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
 [答案](1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。
[答案](1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。
 (2)防止反应过程中空气进入反应管;便于观察N2的流速
(2)防止反应过程中空气进入反应管;便于观察N2的流速
 (3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。
(3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。
 (4)①2.80
(4)①2.80
②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2。若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3。
(广东) 21.
21. 三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。

 限选试剂:浓硫酸、1.0
mol·L-1HNO3、1.0
mol·L-1盐酸、1.0 mol·L-1
NaOH、3%
H2O2 、0.1mol·L-1KI、0.1
mol·L-1CuSO4、20%
KSCN、澄清石灰水、氧化铜、蒸馏水。
限选试剂:浓硫酸、1.0
mol·L-1HNO3、1.0
mol·L-1盐酸、1.0 mol·L-1
NaOH、3%
H2O2 、0.1mol·L-1KI、0.1
mol·L-1CuSO4、20%
KSCN、澄清石灰水、氧化铜、蒸馏水。
 (1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
 (2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是
,现象是
。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是
,现象是
。
 (3)固体产物中铁元素存在形式的探究。
(3)固体产物中铁元素存在形式的探究。
 ①提出合理假设
①提出合理假设
 假设1:
;
假设2:
;假设3:
。
假设1:
;
假设2:
;假设3:
。
 ②设计实验方案证明你的假设(不要在答题卡上作答)
②设计实验方案证明你的假设(不要在答题卡上作答)
 ③实验过程
③实验过程
 根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。


 [答案](1)CO2和CO
[答案](1)CO2和CO
 (2)利用焰色反应 透过蓝色钴玻璃,观察到紫色的火焰
(2)利用焰色反应 透过蓝色钴玻璃,观察到紫色的火焰
 (3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
(3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物与试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量硫酸铜溶液,再加入少量不溶固体,充分振荡 |
(1)
若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2)  若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在 若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2 ,充分振荡后滴加KSCN |
结合步骤2中的(2): (1)  若溶液基本无色,则假设1成立 若溶液基本无色,则假设1成立(2)  若溶液呈血红色,则假设3成立 若溶液呈血红色,则假设3成立 |
(海南) 16.
16. 下图表示从固体混合物中分离X的2种方案,请回答有关问题。
下图表示从固体混合物中分离X的2种方案,请回答有关问题。

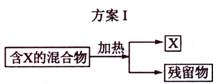
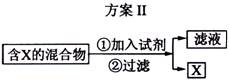
 (1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
(1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
 (2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
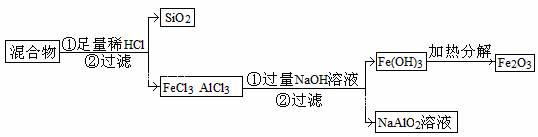
 (3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
答案(1)加热时可升华,或易挥发 热稳定性好,且没有挥发性
(2)浓硝酸,Ag+2HNO3(浓) = AgNO3 + NO2 ↑+ H2O;
Cu + 4 HNO3(浓) = Cu(NO3)2 + 2NO2 ↑+2 H2O
(3)
(安徽) 27.
27.
 某厂废水中含5.00×10-3mol·L-1的
某厂废水中含5.00×10-3mol·L-1的 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
( 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
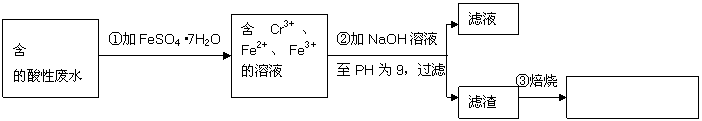






 (1)第①步反应的离子方程式是
(1)第①步反应的离子方程式是
 (2)第②步中用PH试纸测定溶液PH的操作是:
(2)第②步中用PH试纸测定溶液PH的操作是:

 (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
 (4)欲使1L该废水中的
(4)欲使1L该废水中的 完全转化为
完全转化为 。理论上需要加入
。理论上需要加入
 GFeSO4·7H2O。
GFeSO4·7H2O。
 答案:
答案:
 (1)Cr2O72- + 6Fe2+ + 14H+
(1)Cr2O72- + 6Fe2+ + 14H+  2Cr3+
+ 6Fe3+ + 7H2O
2Cr3+
+ 6Fe3+ + 7H2O
 (2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
 (3)Fe(OH)3、Fe(OH)2
(3)Fe(OH)3、Fe(OH)2

 (4)13.9
(4)13.9
(宁夏) 26.碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
26.碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题:
 ①写出xCuCO3·yCu(OH)
2·zH2O与氢气反应的化学方程式
;
①写出xCuCO3·yCu(OH)
2·zH2O与氢气反应的化学方程式
;
 ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):

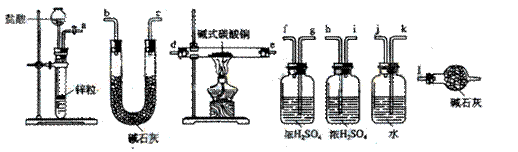 (a)→( )( )→( )(
)→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )(
)→( )( )→( )( )→( )( )→(l)







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
 (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。
 答案(1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H 2
= (x+y)Cu+ xCO2+(x+2y+z)H2O
答案(1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H 2
= (x+y)Cu+ xCO2+(x+2y+z)H2O
 ②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
 ③1.8 CuCO3·Cu(OH) 2·H2O
③1.8 CuCO3·Cu(OH) 2·H2O
 (2)可行 根据反应xCuCO3·yCu(OH) 2·zH2O=(x+y)CuO+
xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
(2)可行 根据反应xCuCO3·yCu(OH) 2·zH2O=(x+y)CuO+
xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
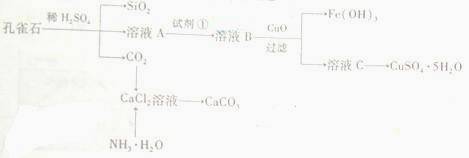
(山东 )30.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
)30.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:




 请回答下列问题:
请回答下列问题:
 (1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
 a.KMnO4 b.(NH4) 2S
c.H2O2
d.KSCN
a.KMnO4 b.(NH4) 2S
c.H2O2
d.KSCN
 (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
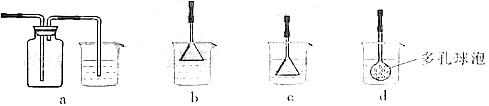
 (3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。



 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。

 [答案](1)c d (2)冷却结晶 引流 (3)NH3 (或NH3·H2O) b d (4)注视凹页面的最低处与刻度线,凹页面的最低处与刻度线相平 酸式
[答案](1)c d (2)冷却结晶 引流 (3)NH3 (或NH3·H2O) b d (4)注视凹页面的最低处与刻度线,凹页面的最低处与刻度线相平 酸式
2、考查化学概念、化学原理知识
 (广东)16. 磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
(广东)16. 磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
 A.H3PW12O40在该酯化反应中其催化作用
A.H3PW12O40在该酯化反应中其催化作用
 B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
 C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
 D.硅钨酸H4
SiW12O40也是一种杂多酸,其中W的化合价为+8
D.硅钨酸H4
SiW12O40也是一种杂多酸,其中W的化合价为+8
 [答案]D
[答案]D
(广东) 23.
23. 磷单质及其化合物的有广泛应用。
磷单质及其化合物的有广泛应用。
(1)  由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
 4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)  H
H
 ①上述反应中,副产物矿渣可用来
。
①上述反应中,副产物矿渣可用来
。
 ②已知相同条件下:
②已知相同条件下:
 4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)

 2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)

 SiO2(s)+CaO(s)=CaSiO3(s)
SiO2(s)+CaO(s)=CaSiO3(s)

 用
用 、
、 和
和 表示
表示 H
H ,
, H
H =
=
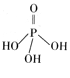
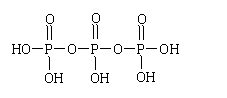
 (2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为

 (3)次磷酸钠(NaH2PO2)可用于化学镀镍。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
 ①NaH2PO2中P元素的化合价为
。
①NaH2PO2中P元素的化合价为
。
 ②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:

 (a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
(a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
 (b)6H2PO2-
+2H+ = 2P+4H2PO3-+3H2↑
(b)6H2PO2-
+2H+ = 2P+4H2PO3-+3H2↑
 请在答题卡上写出并配平反应式(a)。
请在答题卡上写出并配平反应式(a)。
 ③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
 方法上的不同点:
;原理上的不同点:
;化学镀的优点:
。
方法上的不同点:
;原理上的不同点:
;化学镀的优点:
。
 [答案]
[答案]
 ①生产水泥等建筑材料
①生产水泥等建筑材料
 ②
②  +3
+3 +18
+18
 (2)
(2)
 Na5P3O10
Na5P3O10
 (3)①+1
(3)①+1
 ② 1 Ni2+ + 1 H2PO2-+ 1 H2O → 1
Ni + 1 H2PO3- + 2H+
② 1 Ni2+ + 1 H2PO2-+ 1 H2O → 1
Ni + 1 H2PO3- + 2H+
 ③ 化学镀无需通电,而电镀需要通电
③ 化学镀无需通电,而电镀需要通电
 都利用氧化还原反应
都利用氧化还原反应
 化学镀对镀件的导电性无特殊要求
化学镀对镀件的导电性无特殊要求
(海南) 15.
15. Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;

 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
答案(1)负极材料为Li(还原剂),Li – e- = Li+
(2)2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)出现白雾,有刺激性气体生成SOCl2 + H2O = SO2 ↑+ 2HCl↑
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
(江苏) 7. 在下列各溶液中,离子一定能大量共存的是
7. 在下列各溶液中,离子一定能大量共存的是
 A.强碱性溶液中: K+、Al3+、Cl-、SO42-
A.强碱性溶液中: K+、Al3+、Cl-、SO42-
 B.
含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
B.
含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
 C.
含有0.1 mol·L-1 Ca2+溶液在中: Na+、K+、CO32-、Cl-
C.
含有0.1 mol·L-1 Ca2+溶液在中: Na+、K+、CO32-、Cl-
 D.
室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
D.
室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
 [答案]D
[答案]D
(江苏) 11. 下列离子方程式与所述事实相符且正确的是
11. 下列离子方程式与所述事实相符且正确的是
 A.漂白粉溶液在空气中失效:
A.漂白粉溶液在空气中失效:
 B.用浓盐酸与
B.用浓盐酸与 反应制取少量氯气:
反应制取少量氯气:
 C.向
C.向 溶液中通入过量
溶液中通入过量 制
制 :
:


 D.在强碱溶液中次氯酸钠与
D.在强碱溶液中次氯酸钠与 反应生成
反应生成 :
:


 [答案]C
[答案]C
 w(江苏)
w(江苏) 17.废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
17.废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
 A.热裂解形成燃油 B.露天焚烧
A.热裂解形成燃油 B.露天焚烧
 C.作为有机复合建筑材料的原料
D.直接填埋
C.作为有机复合建筑材料的原料
D.直接填埋
 (2)用
(2)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

 ====
====


 ====
====


 ====
==== 

 在
在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化学方程式为 。
的热化学方程式为 。
 (3)控制其他条件相同,印刷电路板的金属粉末用10℅
(3)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 ( ( ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
 (4)在提纯后的
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。
 [答案](1)BD
[答案](1)BD
 (2) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
(2) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
 (3)H2O2 分解速率加快
(3)H2O2 分解速率加快
 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
(福建 )23.
)23.

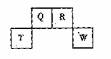 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
 (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______.
 (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
 (3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
 (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
 [答案]
[答案]
 (1)
(1) (2)弱于
(2)弱于
 (3)S
+ 2H2SO4(浓)
(3)S
+ 2H2SO4(浓)  3SO2↑+ 2H2O
3SO2↑+ 2H2O
 (4)2H2O2
MnO22H2O + O2↑(或其他合理答案)
(4)2H2O2
MnO22H2O + O2↑(或其他合理答案)
 (5)NaNO2
(5)NaNO2
 (6)(3a – 4b)KJ/mol
(6)(3a – 4b)KJ/mol
(安徽) 10.在溶液中能大量共存的一组离子或分子是
10.在溶液中能大量共存的一组离子或分子是
 A.
A. 、
、 、
、 、
、
 B.K+ 、Al3+、
B.K+ 、Al3+、 、NH3·H2O
、NH3·H2O
 C.Na+、K+、
C.Na+、K+、 、Cl2
、Cl2
 D.Na+ 、CH3COO-、
D.Na+ 、CH3COO-、 、OH-
、OH-
 答案:D
答案:D
(安徽) 12.Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O
12.Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是
。下列说法正确的是
 A.石墨电极上产生氢气
A.石墨电极上产生氢气
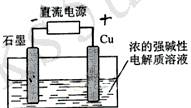
 B.铜电极发生还原反应
B.铜电极发生还原反应
 C.铜电极接直流电源的负极
C.铜电极接直流电源的负极
 D.当有0.1mol电子转移时,有0.1molCu2O生成。
D.当有0.1mol电子转移时,有0.1molCu2O生成。
 答案:A
答案:A

 (宁夏)
(宁夏) 12.能正确表示下列反应的例子方程式是
12.能正确表示下列反应的例子方程式是
 A.
向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O
=CaCO3↓+2HClO
A.
向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O
=CaCO3↓+2HClO
 B.
向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=
CaSO3↓+2HClO
B.
向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=
CaSO3↓+2HClO
 C.
氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.
氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
 D.
在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D.
在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
 答案D
答案D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com