
1.下列各组词语中加点的字,注音全都正确的一组是( )(3分)
A.炫耀(xuàn) 蛮横(hèng) 百舸争流(gě) 不屈不挠(náo)
B.粘贴(nián) 戕害(qiāng) 锲而不舍(qiè) 独出机杼(zhù)
C.引擎(qíng) 蝉蜕(tuì) 按捺不住(nài) 冯虚御风(píng)
D.广袤(mào) 狙击(zǔ) 转弯抹角(mò) 怦然心动(pēng)
25.(6分)海水中含有多种盐类物质,在一定温度下将海水不断浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,下表为一定温度下不同密度的海水中几种盐类的含量(g/mL)
|
海水密度(g/mL) |
CaSO4 (g/L) |
NaCl (g/L) |
MgCl2 (g/L) |
MgSO4 (g/L) |
NaBr (g/L) |
|
1.13 |
0.56 |
|
|
|
|
|
1.20 |
0.91 |
|
|
|
|
|
1.21 |
0.05 |
3.26 |
0.004 |
0.008 |
|
|
1.22 |
0.015 |
9.65 |
0.01 |
0.04 |
|
|
1.26 |
0.01 |
2.64 |
0.02 |
0.02 |
0.04 |
|
1.31 |
|
1.40 |
0.54 |
0.03 |
0.06 |
回答下列问题:
(1)在该温度下恒温蒸发海水时,海水的密度从1.13 g/mL增大到1.21 g/mL时是否有硫酸钙析出? ▲
(2)恒温下,当蒸发1 m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为 ▲ kg,析出NaCl的质量为 ▲ kg。
2010年高考科目教学质量第一次检测
24.(7分)下图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图。
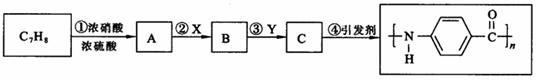
回答下列问题:
(1)聚酰胺类物质所具有的结构特征是 ▲ 。(用结构简式表示)
(2)反应①通常应控制的温度为30℃左右,在实际生产过程中应给反应体系加热还是降温?为什么? ▲ 。若该反应在100℃条件下进行,则其化学反应方程式为 ▲ 。
(3)反应②和反应③从氧化还原反应的角度看是 ▲ 基团被氧化为 ▲ 基团,
▲ 基团被还原为 ▲ 基团。从反应的顺序看,应先发生氧化反应还是还原反应?为什么? ▲ 。
(4)反应④属于 ▲ 反应。
23.(6分)食品安全关系国计民生,影响食品安全的因素很多。下面是以食品为主题的相关问题,请根据要求回答。
(1)聚偏二氯乙烯(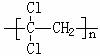 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____ ▲ ____(写结构简式)单体发生加聚反应生成的。若以乙炔为原料,通过加成反应生成1,1,2-三氯乙烷,再和氢氧化钠醇溶液反应可合成这种单体,则在上述加成反应中宜选择的加成试剂是 ▲ 。(选填编号字母)
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____ ▲ ____(写结构简式)单体发生加聚反应生成的。若以乙炔为原料,通过加成反应生成1,1,2-三氯乙烷,再和氢氧化钠醇溶液反应可合成这种单体,则在上述加成反应中宜选择的加成试剂是 ▲ 。(选填编号字母)
A. HCl B. Cl2 C. HClO D.NaCl
(2)人们从食用植物油中摄取的亚油酸[ ]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低。下列关于亚油酸的说法中不正确的是______▲________。(选填编号字母)
]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低。下列关于亚油酸的说法中不正确的是______▲________。(选填编号字母)
A.分子式为C18H34O2
B.在食用油中亚油酸通常是以甘油酯的形式存在
C.亚油酸属于一种不饱和低级脂肪酸
D.亚油酸含量高的植物油在空气中易氧化变质
(3)木糖醇 [ CH2OH(CHOH)3CH2OH]作为一种甜味剂,食用后不会引起血糖升高,比较适合于糖尿病人食用。请预测木糖醇能否和新制备的Cu(OH)2浊液发生化学反应?预测的依据是 ▲ 。
(4)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得 A 的相对分子质量为 60
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值 (信号),根据 峰值 (信号) 可以确定分子中氢原子的种类和数目。例如:乙醇 (CH3CH2OH) 有三种氢原子 (图1)。经测定,有机物 A 的核磁共振氢谱示意图如图2
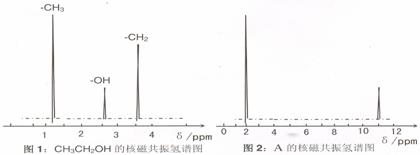
③对 A的水溶液进行测定发现该溶液pH< 7
根据以上分析,写出 A 的结构简式 ▲ 。
22.(7分)已知: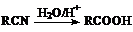 ,丙烯是重要的化工原料,一定条件下可发生下列转化:
,丙烯是重要的化工原料,一定条件下可发生下列转化:
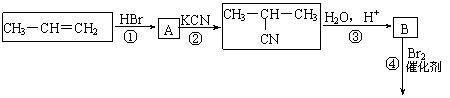
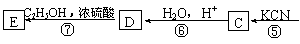
回答下列问题:
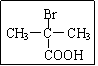
⑴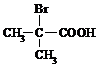 与足量NaOH溶液反应的化学方程式为 ▲ 。
与足量NaOH溶液反应的化学方程式为 ▲ 。
⑵D与足量乙醇反应生成E的化学方程式为______▲_____。
⑶B的同分异构体有多种。写出其中既能发生银镜反应,又能发生酯化反应且结构中只有一个甲基的所有可能的物质的结构简式 ▲ 。
21.(8分)一实验小组的同学查阅了20℃时,一些物质的溶解度数据:
|
物质 |
Ba(NO3)2 |
NH4Cl |
BaCl2 |
NH4NO3 |
NaCl |
Ba(OH)2 |
|
溶解度 |
8.3 |
27.3 |
26.3 |
63.5 |
26.4 |
4.3 |
并做了如下四个实验:
实验一:取氯化钡固体配成饱和溶液,再向其中加入硝酸铵固体至恰好不溶为止。
实验二:向上述溶液中加入一定量氢氧化钠溶液,发现产生大量白色沉淀,并闻到刺激性气体气味。将所得沉淀反复水洗后分成两份。
实验三:向一份沉淀中加入足量稀盐酸。
实验四:向另一份沉淀中加入足量稀硫酸,再加足量稀盐酸。
回答下列问题:
(1)实验二中发生的化学反应的离子方程式为 ▲ 。
(2)实验三中观察到的实验现象为 ▲ 。
(3)实验四中观察到的实验现象为 ▲ ;相关的化学方程式为 ▲ 。
20.(6分)某同学进行了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
|
实验 序号 |
反应温度 (℃) |
参加反应的物质 |
||||
|
Na2S2O3 |
H2SO4 |
H2O |
||||
|
V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
V/mL |
||
|
A |
20 |
10 |
0.1 |
10 |
0.1 |
0 |
|
B |
20 |
5 |
0.1 |
10 |
0.1 |
5 |
|
C |
20 |
10 |
0.1 |
5 |
0.1 |
5 |
|
D |
40 |
5 |
0.1 |
10 |
0.1 |
5 |
(1)写出上述反应的离子方程式 ▲
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 ▲ (填实验序号)
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。其中:
①能说明温度对该反应速率影响的组合比较是 ▲ ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是 ▲
③B和C的组合比较所研究的问题是 ▲
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较: ▲
19.(7分)对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应原理的系列研究,请根据相关信息回答有关问题。
(1) 关于反应生成物的定量研究:
已知反应:Br2+2Fe2+== 2Br-+2Fe3+ ,向10 mL 0.1 mol·L–1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定 ▲ 。(填字母序号)
A.含Fe2+,不含Fe3+ B.含Fe3+,不含Br- C.含Fe3+,含有Br-
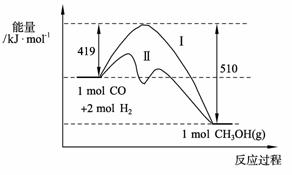 (2)关于反应限度的研究:
(2)关于反应限度的研究:
已知在773 K、固定体积的容器中,反应
CO(g)+2H2(g) CH3OH(g)过程中能量变
CH3OH(g)过程中能量变
化如右图。曲线Ⅱ表示使用催化剂时的能量
变化。若投入a mol CO、2a mol H2,平衡
时能生成0.1a mol CH3OH,反应就具工业应用价值。
① 若按上述投料比使该反应具有工业应用
价值,CO的平衡转化率最小为 ▲ ;
②在容器容积不变的前提下,欲提高H2的转
化率,可采取的措施(答两项即可): ▲ 、 ▲ ;
(3)关于反应速率的研究:
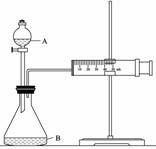 氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生 的一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O
氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生 的一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O
① KMnO4、Na2CO3、CuO、KI四种物质中的 ▲ (填化学式)
能使上述还原过程发生。
② 欲用右图装置测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 定 ▲ 推(计)算反应速率。
18.(7分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸的反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。
①可观察到实验现象是 ▲ ,②反应过程中发生反应的化学方程式是 ▲ 。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现血红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
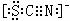 I.铁有一种化合物称为铁酸盐(含有FeO42-)。
I.铁有一种化合物称为铁酸盐(含有FeO42-)。
II.SCN-的电子式为 。
III.氯水具有很强的氧化性。
于是同学们提出两种假设,
①第一种假设是:Cl2可将Fe3+氧化为FeO42-,请写出该离子反应方程式 ▲ 。
②第二种假设是: ▲ ,提出该假设的理论依据是 ▲ 。
17.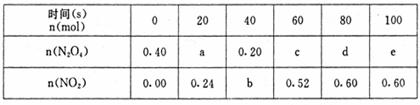 (6分)80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
(6分)80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:





 (1)计算20s-40s内用N2O4表示的平均反应速率为 ▲ mol·L-1·s-1
(1)计算20s-40s内用N2O4表示的平均反应速率为 ▲ mol·L-1·s-1
 (2)计算在80℃时该反应的平衡常数K= ▲
;
(2)计算在80℃时该反应的平衡常数K= ▲
;

 (3)要增大该反应的K值,可采取的措施有(填序号) ▲
(3)要增大该反应的K值,可采取的措施有(填序号) ▲
 A.增大N2O4的起始浓度
A.增大N2O4的起始浓度
 B.向混合气体中通入NO2
B.向混合气体中通入NO2
 C.使用高效催化剂
C.使用高效催化剂
 D.升高温度
D.升高温度
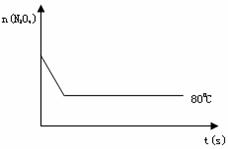
 (4)如右图是80℃时容器中N2O4物质的量的变化
(4)如右图是80℃时容器中N2O4物质的量的变化 曲
曲
线,请在该图中补画出该反应在60℃时 N2O4物
N2O4物
质的量的变化曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com