
6.在下列五种物质的组合中,既能跟氢氧化钠溶液反应,又能跟盐酸反应,且在生成物中都有盐和水的是
①Al ②Al(OH)3 ③Al2O3 ④MgCO3 ⑤Mg(HCO3)2
A.①②③ B.①③⑤ C.②③⑤ D.②④⑤
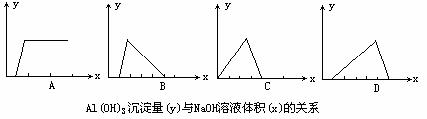
5.将NaOH溶液逐滴加入用盐酸酸化了的AlCl3溶液中,若用y轴表示Al(OH)3沉淀量,x轴表示NaOH溶液的体积,下列图象正确的是
4.从海水中提取金属镁,主要步骤有以下五步:①浓缩结晶②加熟石灰③加盐酸④电解⑤过滤,正确的顺序是
A.①②③④⑤ B.③⑤①②④ C.②⑤③①④ D.④③⑤①②
3.用含少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为:①加盐酸溶解;②加苛性钠溶液;③过滤;④通入过量CO2;⑤加过量纯碱溶液。实验操作最合理的组合及顺序是
A.①⑤④③ B.②③④③ C.②③⑤③ D.①⑤③
2.在相同条件下,将镁、铝分别投入质量相等且足量的稀硫酸中,反应结束后,两溶液的质量仍相等,则镁和铝的关系是
A.质量比1∶1 B.物质的量之比1∶1
C.质量比12∶9 D.质量比32∶33
1.能说明钠、镁、铝的金属性依次减弱的是
A.钠、镁、铝的化合价依次升高
B.钠、镁、铝元素形成的氢氧化物碱性依次减弱
C.钠、镁、铝分别与酸反应时,其原子失去电子的数目依次增加
D.钠遇冷水剧烈反应,镁与沸水有明显反应,铝与沸水也很难反应
0.15 0.15×3 -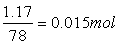
-Al3+-+-4OH-══AlO2-+2H20
-1mol 4mol
-0.2×0.1-0.015=0.005 0.005×4
-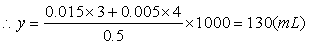
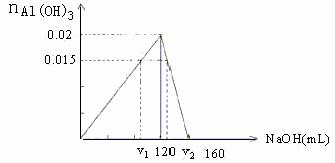
(解法二:此题可用图象法会更直观,请同学们自己课下分析)
[练习]
0.5mol×27g/mol=13.5g
所以答案为C,D。
例4.在0.2mol/L的AlCl3溶液100mL中,如果要得到1.17g沉淀,则需加入-0.5mol/L的NaOH溶液多少毫升?
解法一:AlCl3与NaOH反应时,当AlCl3过量时,只生成Al(OH)3,当NaOH
过量时,Al(OH)3沉淀又会部分溶解,所以,此题应有两种结果。
(1)当AlCl3过量时,设需加入xmolNaOH溶液才能得到1.17gAl(OH)3沉淀。
-Al3++3OH-══Al(OH)3↓
-3mol -1mol
-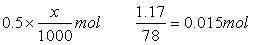
-解之得:x=90mL
(2)当NaOH过量时,设需加入ymLNaOH溶液才能得到1.17gAl(OH)3沉
-淀。
-Al3+-+ 3OH-══Al(OH)3↓
-1mol 3mol -1mol
0.05mol×24g/mol=1.2g,
3、氢氧化铝
(1)制取
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
Al3++3 NH3·H2O=Al(OH)3↓+3NH4+
(2)Al(OH)3的两性
Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+NaOH=NaAlO2+2H2O
(3)Al(OH)3不稳定:2Al(OH)3 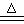 Al2O3+3H2O
Al2O3+3H2O
[例题]
例1、由锌、铁、铝、镁四种金属中的两种组成化合物10g,与足量的盐酸反应产生
的氢气在标况下为11.2L。则化合物中一定含有的金属是
A. 锌 B. 铁 C. 铝 D. 镁
解析:根据锌、铁、铝、镁四种金属与盐酸反应的方程式可知生成11.2L氢气需要各
金属的质量分别为:锌32.5g、铁28g、铝9g、镁12g。由此可得出化合物中一定含有铝。 答案选:C
例2、将分别盛有50mL1mol/L的硫酸的两个烧杯置于托盘天平的两盘上,
并调平。再向两杯中分别加入下列各组金属,反应完毕后,天平仍处于平衡的是
A.同是0.2mol钠和镁 B.同是1.5g铝和锌
C.同是1.5g铝和镁 D.同是1mol镁和铝 解析: 把选项分别代入,A,B,D两边增重不等,均被排除。所以C为答案。
例3、有镁、铝合金14.7g,全部溶于500mL6.0mol/L的盐酸中充分反应后,再加入400mL8.0mol/L的NaOH溶液,结果得到沉淀26.3g,则合金中镁、铝的质量分别为。
A.13.5g和1.2g B.10.2g和4.5g C.1.2g和13.5g D.10.9g和3.8g
解析:镁和铝都能溶于盐酸,溶解后生成的镁盐和铝盐都能与NaOH反应,剩余的盐酸也能与NaOH反应,若NaOH过量还能将Al(OH)3溶解。反应的一系列离子方程式如下:
Al+3H+=Al3++(3/2)H2↑
Al3++3OH-=Al(OH)3↓
Mg+2H+=Mg2++H2↑
Mg2++2OH-=Mg(OH)2↓
H++OH-=H2O
当NaOH过量时,还有:
Al(OH)3+OH-=AlO2-+2H2O
讨论:若26.3g沉淀全都是Mg(OH)2,则镁的质量为26.3g/58×24=10.9g,铝的质量为14.7g-10.9g=3.8g;
若 26.3g沉淀为Mg(OH)2与Al(OH)3的混合物,则设合金中铝为x,镁为y,则:
27x+24y=14.7mol
[x-(0.4×8-0.5×6)mol]×78g/mol+58g/moly=2.63g
解之得:x=0.5mol y=0.05mol
合金中镁和铝的质量分别为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com