
2、下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是
A.Na2O2与CO2 B.Na与O2
C.NaOH与CO2 D.碳与O2
1、金属钠露置在空气中,在其表面不可能生成的物质是
A.Na2O B.NaOH C.Na2CO3 D.NaCl
3、(1)碳酸钠和碳酸氢钠在水中的溶解性:Na2CO3 〉NaHCO3
 (2)受热分解
(碳酸钠较稳定,碳酸氢钠受热不稳定:)
(2)受热分解
(碳酸钠较稳定,碳酸氢钠受热不稳定:)

 2NaHCO3 Na2CO3
+ CO2 ↑ + H2O
2NaHCO3 Na2CO3
+ CO2 ↑ + H2O
(3)与盐酸反应:
Na2CO3 + 2HCl = 2NaCl + CO2 ↑ + H2O
NaHCO3 + HCl = NaCl + CO2 ↑+ H2O
[例题]
例1、将足量的金属钠投入到100gt°C的水中,恰好得到t°C时NaOH饱和溶液111g,则t°C时NaOH的溶解度为____克。
分析解答:由于2Na+2H2O=NaOH+H2↑所以,反应前总质量为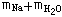 ,反应后总质量为
,反应后总质量为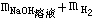
若设Na的物质的量为xmol,则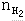 =
=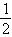 xmol.据质量守恒定律有:23x+100=111+
xmol.据质量守恒定律有:23x+100=111+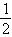 x×2,得x=0.5
x×2,得x=0.5
∴  =0.5mol×40g/mol=20g
=0.5mol×40g/mol=20g
例2、用1L1.0mol/LNaOH溶液吸收0.8molCO2,所以溶液中的CO32-,HCO3-的物质的量浓度之比为_____。
分析提示:Na+在反应后转化为Na2CO3及NaHCO3这两种形式的物质,C原子在反应后进入CO32-及HCO3-中,设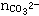 =xmol
=xmol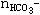 =ymol,据Na+守恒有:2x+y=1.0mol/L×1L 据C守恒有:x+y=0.8mol 答案:1:3
=ymol,据Na+守恒有:2x+y=1.0mol/L×1L 据C守恒有:x+y=0.8mol 答案:1:3
例3、A、B、C三种金属相对原子质量之比为3:5:7,若以4:2:1的原子个数比形成三种金属组成的混合物4.64g,溶于足量的盐酸后,放出氢气在标准状况下的体积是3. 136L,若三种金属均为正2价,求三种金属的相对原子质量。
分析:由于三种金属均为+2价,所以三种金属物质的量之和等于与盐酸反应生成氢气的物质的量,由此可以求出混合金属的平均相对原子质量,由此可求出三种金属相对原子质量。
解: 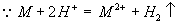 ∴混合金属的物质的量=H2的物质的量=
∴混合金属的物质的量=H2的物质的量= 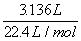 =0.14mol
混合金属的平均摩尔质 量=
=0.14mol
混合金属的平均摩尔质 量= 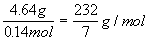 设:A、B、C三种金属的相对原子质量分别是3x、5x、7x
则:
设:A、B、C三种金属的相对原子质量分别是3x、5x、7x
则: 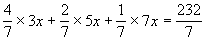 解之,x=8
∴A、B、C三种金属的相对原子质量分别是:24、40、56。
解之,x=8
∴A、B、C三种金属的相对原子质量分别是:24、40、56。
例4 200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应,反应后固体的质量增加了3.6g。则原混合气体的平均式量为
A.5.8 B.11.6 C.23.2 D.46.4
分析:此题可以有多种解法,这里介绍三种,同学们可以通过比较,找出规律,理智地采用最佳方法求出答案。
解法一:差量法
设原混合气体中含CO2和H2O物质的量分别为x、y
2Na2O2 + 2CO2 === 2Na2CO3 + O2 固体质量增加
78×2g 2mol 106×2g (212-156)g
x 28x
2Na2O2 + 2H2O === 4NaOH + O2 固体质量增加
78×2g 2mol 40×4g 4g
y 2y
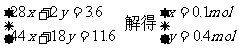
则混合气的平均式量为:
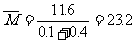 故选C
故选C
解法二:平均值法
由方程式:2CO2 + 2Na2O2
=== 2Na2CO3 + O2和2H2O + 2Na2O2 === 4NaOH + O2可知,固体增加的质量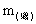 ,应是
,应是 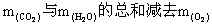 之值,即:
之值,即:
 所以,
所以,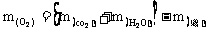
这样, 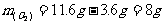
则O2物质的量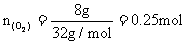
又由于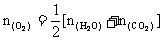 所以混合气总物质的量
所以混合气总物质的量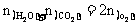
因此混合气体的平均式量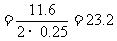
解法三:估算法
CO2的式量为44,水蒸气的式量为18,因此两种气体的混合物的平均式量必介于二者之间,故应选C。
小结:由上可见,在解计算选择题时墨守成规的用通常方法即差量法往往麻烦费时,显然在此采用估算法是最简便的方法。
[练习]
2、氧化物与过氧化钠:
Na2O+H2O====2NaOH Na2O+CO2====Na2CO3
2Na2O2+2H2O====4NaOH+O2↑ 2Na2O2+2CO2====2Na2CO3+O2↑
1、①与氧气反应:
4Na+O2=2Na2O 2Na+O2 Na2O2 (淡黄色)
Na2O2 (淡黄色)
②钠与水的反应 2Na+2H2O====2NaOH+H2↑
31.(1)② (2)过滤
1.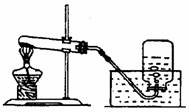 (2010.浙江丽水)31.如图是实验室加热KClO3与MnO2的混合物制取氧气的装置图。
(2010.浙江丽水)31.如图是实验室加热KClO3与MnO2的混合物制取氧气的装置图。
(1)下列操作顺序合理的是 ▲ (填序号);
①先加药品、再检查装置的气密性
②先检查装置的气密性、再加药品
(2)实验结束后,若要回收MnO2,则可将试管内的剩余物经溶解、 ▲ 、洗涤、干燥等加以回收。
2.(2010.浙江丽水)7.实验室制取气体选择收集方法时,下列性质:①颜色;②密度;③溶解性;④可燃性;⑤能否与水反应,必须考虑的是
A.①②③ B.②③④ C.③④⑤ D.②③⑤
1.(2010.浙江杭州)18.实验室用高锰酸钾制取氧气,用锌和稀硫酸制取氢气,下列叙述正确的是
A.可以用同一套气体发生装置 B.可以用同一种气体收集方法
C.属于同种基本反应类型 D.反应条件相同
34.(1)除去广口瓶内空气中的氧气(2分)
(2)小于(2分)
(3)2Mg+O2==2MgO 3Mg+N2==Mg3N2(3分,写一个方程式得2分)
考点4 氧气的性质与制备(包括催化剂)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com