
14. (09年福建理综·8)设NA为阿伏伽德罗常数,下列叙述正确的是
(09年福建理综·8)设NA为阿伏伽德罗常数,下列叙述正确的是
 A.24g镁的原子量最外层电子数为NA
A.24g镁的原子量最外层电子数为NA
B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
 C.1mol甲烷分子所含质子数为10NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
答案:C
解析:A项,镁的最外层电子数为2,故错;B项,乙酸为弱电解质,部分电离,故H+小于0.1NA,错;C项,CH4的质子数为10,正确;D项,乙醇标状下不是气体,错。
13.(08年山东理综·13)NA代表阿伏伽德罗常数,下列叙述错误的是A
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1NH4Cl溶液与2 L0.25mol·L-1NH4Cl溶液含NH4+物质的量不同
答案:A
解析:选项A中根据稀释前后溶质的质量不变得:10mL×ρ(前)×98%=100mL×ρ(后)×ω(后),所以ω(后)=,由于反应前后溶液的密度不能确定,所以其质量分数也不能确定;选项B中n(O2)=1mol,O元素的化合价从-1价变为0价,所以每个O原子失去1个电子,故反应中转移的电子数为2NA;选项C中分子数为NA的CO和C2H4其物质的量为1mol,则在标准状况下所占的体积为22.4L,由于它们的摩尔质量都是28g·mol-1,即平均摩尔质量也为28g·mol-1,所以其质量为28g;选项D中由于NH4++H2O NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
12.(08年江苏化学·3)用NA表示阿伏加德罗常数的值。下列叙述正确的是C
A.常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
B.标准状况下,22.4 L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1 L浓度为1 mol·L-1的Na2CO3溶液中含有NA个CO32-
答案:C
解析:选项A中n(Al)=1mol,Cl2的物质的量不能确定,当Cl2的物质的量小于1.5mol时,转移的电子数小于3NA,当Cl2的物质的量等于或大于1.5mol时,转移的电子数为1.5mol;己烷在标准状况下为液体,所以其物质的量不能用n=来确定;选项C中含有NA个分子的CO2和O2,其物质的量为1mol,而不管是CO2还是O2 1mol中均含有2mol的O,NA个CO2和O2的混合气体所含的O数为1mol;选项D中CO32-为弱酸根离子,水解后使得CO32-的物质的量小于1mol,CO32-的个数小于NA。
11.(08年海南化学·5)设NA为阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
答案:C
解析:选项A中CCl4在标准状况下为液体,所以其物质的量时不能用n=V/22.4计算,选项B中n(N2)=0.5mol,1molN2中含有14mol电子,所以0.5molN2含有7NA;选项C中在标准状况下,22.4L的气体为1mol,不管是混合气体还是纯净的气体,所含的分子数均为NA;选项D中生成1molH2,转移的电子数必定为2NA。
10.(08年海南化学·3)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是B
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
答案:B
解析:根据阿伏加德罗定律可知同温同压下气体的密度之比等于摩尔质量之比,即=,由于>1,所以M(甲)>M(乙);由于它们的质量相等,所以甲的物质的量比乙的物质的量少,甲的分子数比乙少;由于它们的外界条件相同,所以它们的摩尔体积相同。
9.(08年广东理基·19)能表示阿伏加德罗常数的数值是C
A.1 mol金属钠含有的电子数
B.标准状况下,22.4L苯所含的分子数
C.0.012 g 12C所含的原子数
D.1 L1 mol/L的硫酸溶液中所含的H+
答案: C
解析: A. 1mol 金属钠含有的电子数为11NA,而含有的最外层电子数为1NA;
B. 标准状况下苯为液态;
C. 0.012kg12C所含的原子数为NA;
D. 硫酸分子式为H2SO4,电离时H2SO4=2H++SO42-。因此,所含H+数应为2NA
8.(08年广东化学·10)设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是BC
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
答案:BC
解析:Fe过量可使Fe3+还原为Fe2+,A错误。3NO2+H2O==2HNO3+NO,易知B正确。C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果。3Fe+4H2O===Fe3O4+4H2↑,由方程可知D错误。
7.(08年广东化学·6)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是A
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
答案:A
解析:m(Al):m(NaOH)=27:40;
m(Al(OH)3):m(NaOH)=75:40;
m(AlCl3):m(NaOH)=33.375:40;
m(Al2O3):m(NaOH)=51:40;
所以相同质量的物质,消耗碱量最多的是Al。故选A。
6.(2007海南·12)有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl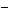 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
答案:D
考点:本题考查了物质的量的相关计算。
解析:本题的解题关键是将溶液分成两份,即每份体积为a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(Cl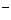 )=n( AgNO3)=ymol,根据电荷守恒
)=n( AgNO3)=ymol,根据电荷守恒
2x[Ba2+]+[Na+]=[Cl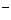 ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl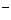 )。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
)。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
5.(2007海南·4)下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
答案:B
考点:本题考查了阿伏加德罗定律及其应用。
解析:由PV=nRT可知:气体的体积在温度、压强一定时,体积与物质的量成正比;当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小。 所以A、D错;B正确;只有标况下气体摩尔体积才近似为22.4L/mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com