
6.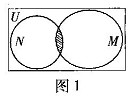 (广东理.1) 已知全集
(广东理.1) 已知全集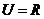 ,集合
,集合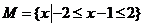 和
和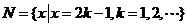 的关系的韦恩(Venn)图如图1所示,则阴影部分所示的集合的元素共有
的关系的韦恩(Venn)图如图1所示,则阴影部分所示的集合的元素共有
A. 3个 B. 2个
C. 1个 D. 无穷多个
[解析]由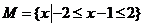 得
得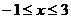 ,则
,则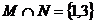 ,有2个,选B.
,有2个,选B.
5. (福建文.1)若集合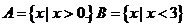 ,则
,则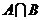 等于
等于
A.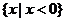 B
B 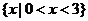 C
C 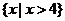 D R
D R
[解析]易知道: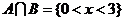 选B
选B
4. (福建理.2)已知全集U=R,集合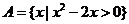 ,则
,则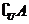 等于
等于
A. { x ∣0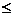 x
x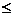 2}
B { x ∣0<x<2}
2}
B { x ∣0<x<2}
C. { x ∣x<0或x>2}
D { x ∣x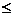 0或x
0或x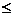 2}
2}
[解析]∵计算可得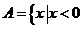 或
或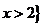 ∴
∴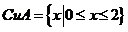 .故选A
.故选A
3.(北京文.1)设集合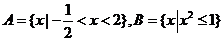 ,
,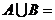 ( )
( )
A.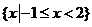 B.
B.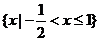
C.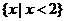 D.
D.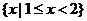
[解析]∵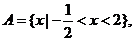
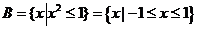 ,
,
∴ 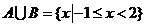 ,故选A.
,故选A.
2. (安徽文.2)若集合A={x∣(2x+1)(x-3)<0},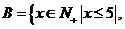 则A∩B是
则A∩B是 (A)
{1,2,3,} (B)
{1,2, }
(A)
{1,2,3,} (B)
{1,2, } 
(C) {4,5} (D) {1,2,3,4,5}
[解析]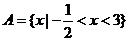 ,
,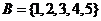 ,∴
,∴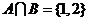 选B
选B
1. (安徽理.2)若集合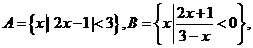 则A∩B是高.考.资.源.网 (A)
则A∩B是高.考.资.源.网 (A)
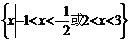 (B)
(B) 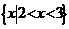 (C)
(C) 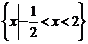 (D)
(D) 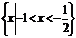 高.考.资.源.网
高.考.资.源.网
[解析]集合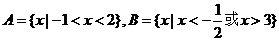 ,
,
∴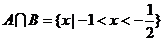 选D
选D
19.(09年山东理综·10)下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若35 17Cl、37 17若Cl为不同的核素,有不同的化学性质 学科
学科
C.实验室制备Cl2,可用排放和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
答案:C
解析:本题以氯元素为载体,从氧化还原、原子结构、收集方法不同角度进行考查,体现了山东理综化学选择题的命题模式。氯气与水的反应既是氧化剂也是还原剂;同一元素的不同核素化学性质几乎完全相同而物理性质不同;D中提Cl2的体积未指明是标准状况。实验室制备Cl2,可用排饱和食盐水集气法收集也可用瓶口向上排空气法收集,故C正确。
20 .(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
.(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
 A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
 B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
 D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
答案:C
解析:A中镁为0.1mol,失去的电子数为0.2 NA;B中盐酸无体积,不能计算出粒子数;D选项中使用气体摩尔体积不是在标准状况下。
21 .(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:
.(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:

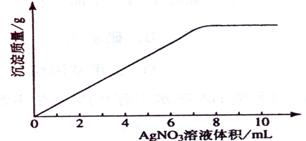
 A.+1 B.+2 C.+3 D.+4
A.+1 B.+2 C.+3 D.+4
答案:C
解析:设氯化物化学式为MClx
MClx -- x AgNO3
1 x
5mL×0.05 mol·L-1 0.1 mol·L-1×7.5mL
x = 3
18.(09年宁夏理综·7)将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O2 C.N2O D.N2O4
答案:A
解析:根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
[点评]本题主要考查气体摩尔体积,阿伏伽德罗常数等知识,题目较为老套,而且这种题目在若干年前就已经经常出现了。
16.(09年广东理基·20)设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.22.4 L Cl2中含有NA个C12分子
B.1 L 0.1 mol·L-1
Na2SO4溶液中有0.1 NA个Na+
C.1 mol H2与1 mol C12反应生成NA个HCl分子
D.1 mol Ca变成Ca2+时失去的电子数为2NA
答案:D
解析:A选项没有指出条件是否为标准状况;B选项中Na+ 的物质的量为0.2mol,因此Na+
的物质的量为0.2mol,因此Na+ 应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol
H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol
Ca失去2NA个电子数变成Ca2+。所以D选项正确。
应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol
H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol
Ca失去2NA个电子数变成Ca2+。所以D选项正确。
 17
17 .(09年江苏化学·4)用NA表示阿伏加德罗常数的值。下列叙述正确的是
.(09年江苏化学·4)用NA表示阿伏加德罗常数的值。下列叙述正确的是
 A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
 B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
 C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
 D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
 答案:C
答案:C
 解析:A项,pH=13也就是意味着c(H+)=1×10-13mol·L-1,则c(OH-)=1×10-1mol·L-1,所以n(OH-)=n(OH-)×V=1×10-1mol·L-1×1L=0.1mol,所以N(OH-)=0.1NA;B项,发生的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O(该反应为歧化反应),n(Cl2)=0.1mol,那么转移电子的数目应该为0.1NA;C项,乙烯和丁烯的最简式都是CH2,则n(CH2)=
解析:A项,pH=13也就是意味着c(H+)=1×10-13mol·L-1,则c(OH-)=1×10-1mol·L-1,所以n(OH-)=n(OH-)×V=1×10-1mol·L-1×1L=0.1mol,所以N(OH-)=0.1NA;B项,发生的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O(该反应为歧化反应),n(Cl2)=0.1mol,那么转移电子的数目应该为0.1NA;C项,乙烯和丁烯的最简式都是CH2,则n(CH2)=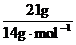 =1.5mol,所以n(C)=01.5mol,N(C)=1.5NA;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为NA。
=1.5mol,所以n(C)=01.5mol,N(C)=1.5NA;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为NA。
 [考点分析]以阿伏伽德罗常数为载体考察如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数。
[考点分析]以阿伏伽德罗常数为载体考察如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数。
15.(09年广东化学·6)设NA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3NA 个氢原子
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
答案:C
解析: K2SO4中阴离子为硫酸根,1mol硫酸根所带电荷为2mol,A错误。乙烯和C3H6的最简式相同均为CH2,28g混合气有2molCH2,所以含4molH原子,B错误。Fe3+在溶液中发生水解,0.1molFeCl3溶液中,Fe3+的物质的量要小于0.1mol,D错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com