
9.答案:C
解析:温度越高,水的电离程度越大,水中氢离子浓度越大。
8.答案:B
解析:酸和碱溶液混合后所得溶液呈酸性,其原因有下列两种可能:(1)两种溶液恰好完全反应,但参与反应的是弱碱和强酸,生成强酸弱碱盐容易水解而显酸性。(2)酸和碱并没有恰好完全反应,反应以后酸有剩余,因而溶液显酸性。本题中的酸溶液H+离子浓度只有1×10-3 mol·L-1。如果此酸是强酸,它是完全电离的,可见它是一种稀溶液;如果是弱酸,因为它只有少部分电离,则弱酸的浓度可能较大。选项B是符合条件的答案,混合后的溶液呈酸性这表明所用的是较浓的弱酸实际上是过量的。如果酸是强酸、碱是弱碱,按前分析,两者不可能是等浓度的,可判断选项C不对。也正是由于这种原因。
7.答案:A
解析:CH3COOH溶液中存在着平衡:CH3COOH CH3COO-+H+,加水稀释平衡往正反应方向移动,电离度增大,溶液中[H+]减小,[OH-]增大,pH增加;加入少量CH3COONa晶体时,平衡向逆反应方向移动,电离度减小,溶液中[OH-]增大,pH增加。
CH3COO-+H+,加水稀释平衡往正反应方向移动,电离度增大,溶液中[H+]减小,[OH-]增大,pH增加;加入少量CH3COONa晶体时,平衡向逆反应方向移动,电离度减小,溶液中[OH-]增大,pH增加。
6.答案:AD
解析:中性溶液中,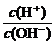 =1,AG=0;酸性溶液中,
=1,AG=0;酸性溶液中,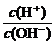 >1,AG<0。常温下0.1 mol·L-1氢氧化钠溶液中,
>1,AG<0。常温下0.1 mol·L-1氢氧化钠溶液中,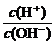 =10-12,AG=-12;常温下0.1 mol·L-1盐酸溶液中,
=10-12,AG=-12;常温下0.1 mol·L-1盐酸溶液中,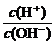 =1012,AG=12。
=1012,AG=12。
5.答案:D
解析:判断某酸是否为强酸的依据是该酸在水溶液中能否完全电离,与其稳定性无关,故A错;酸性比碳酸强的酸就可溶解石灰石,如醋酸,故B不对;Al(OH)3沉淀能溶解在强酸性溶液中,但强酸性溶液不一定是强酸形成的,故C错;pH为1的溶液中c(H+)=0.1 mol·
L-1,与酸的浓度一致,说明该酸为强酸。
4.答案:C
解析:将pH=1的盐酸加适量水,pH升高了1,说明所加的水是原溶液的9倍;另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH升高了1,则可列式10-1×1-
10-1·x=10-2(1+x),解得x=9/11,则加入的水与NaOH溶液的体积比为9∶9/11=11∶1。
3.答案:C
解析:在0.1 mol·L-1氨水中存在平衡NH3·H2O NH
NH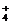 +OH-,碱性溶液遇酚酞呈现红色。若向其中加入少量的NH4Cl晶体,由于溶液中c(NH
+OH-,碱性溶液遇酚酞呈现红色。若向其中加入少量的NH4Cl晶体,由于溶液中c(NH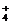 )的增大,导致上述平衡往逆反应方向移动。则溶液的颜色变浅。
)的增大,导致上述平衡往逆反应方向移动。则溶液的颜色变浅。
2.答案:BC
解析:两溶液中CH3COOH的物质的量都是:0.001 mol,中和时所需NaOH的量也应相等;浓度越小,电离度越大,其电离出的H+的物质的量也就越多。
1.答案:D
解析:证明氨水是弱电解质的原理有两个:一是证明氨水不能完全电离,溶液中存在电离平衡;二是证明氨水与强酸反应生成的盐具有弱酸性。选项D就是利用了第二个原理。
35.(1994年全国,31)在25 ℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是 。
●答案解析
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com