
19.答案:A
解析:判断溶液中酸碱性的最根本的依据是H+与OH-的浓度的相对大小。c(H+)>
c(OH-),呈酸性;c(H+)=c(OH-),呈中性;c(H+)<c(OH-),呈碱性。
18.答案:B
解析:溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05 mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,离子浓度增大,导电能力增强;只有0.5 mol·L-1的盐酸,能与NaOH反应生成强电解质NaCl,不影响导电性。
17.答案:A
解析:本题考查生活中的化学。人体血液pH在7.35-7.45之间;蔗糖不电离,溶液显中性;橙汁一般为碳酸型饮料,显弱酸性;胃液中含盐酸,pH<7。
16.答案:C
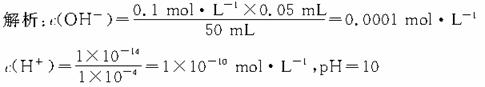
15.答案:C
解析:加热蒸发时,HCl挥发,①中HCl的物质的量减少,消耗的NaOH的物质的量减少,②中虽然加入了CH3COONa,有弱酸CH3COOH生成,但酸的物质的量不变,消耗NaOH的物质的量不变,故答案为C。
14.答案:C
解析:解此题时,首先判断两反应物哪一种过量,如果盐酸过量,直接求混合液中c(H+),再求溶液的pH,如果碱过量,则要先求出c(OH-),再由水的离子积常数求出c(H+),最后求溶液的pH。经判断,此题中酸过量,c(H+)=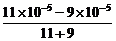 =1×10-6,溶液的pH=6。
=1×10-6,溶液的pH=6。
13.答案:BC
解析:pH相同的盐酸和醋酸都稀释2倍,盐酸中c(H+)变为原来的一半,而醋酸是弱酸,稀释后,电离程度增大,c(H+)比稀释前小,但大于原来浓度的一半,即比盐酸溶液中H+的浓度大,锌与醋酸的反应速率快;酸和锌的量都是已知的,首先进行过量判断,经计算锌的量不足,所以两种溶液放出H2的量是相等的。
12.答案:D
解析:由题中条件可以看出,温度升高后,KW值增大。25℃时c(H+)=c(OH-)=1.0×
10-7mol·L-1,35℃时,c(H+)=c(OH-)=1.45×10-7 mol·L-1。温度升高c(H+)和c(OH-)都增大,且仍然相等,水的电离度也增大。因温度升高平衡向正反应方向移动,故水的电离为吸热反应。
11.答案:D
解析:选项中的四种物质水溶液都能导电,但原因有所不同。CH3COOH和NH4HCO3均为电解质,水溶液理应能导电;Cl2和SO2水溶液能导电,是因为它们与水反应Cl2+H2O===HCl+HClO,SO2+H2O===H2SO3,因生成物均为电解质,故溶液也导电。电解质和非电解质都是化合物,Cl2是单质,因此只有SO2为非电解质。
10.答案:B
解析:两溶液反应后,硫酸过量,剩余H+的物质的量为:0.04 L×2×0.4 mol·L-1-0.06 L×0.5 mol·L-1=2×10-3 mol。c(H+)=2×10-2 mol·L-1,pH=1.7。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com