
2.(08广东卷)对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是(
)
2SO3(g),能增大正反应速率的措施是(
)
A.通入大量O2 B.增大窗口容积
C.移去部分SO3 D.降低体系温度
1.(08上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
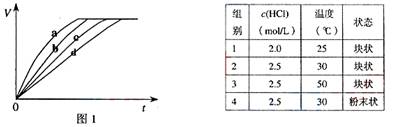
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
33. (05广东卷)研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
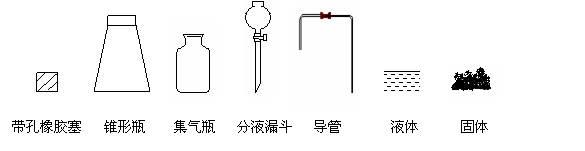
②实验过程中,使用分液漏斗滴加浓硫酸的操作是___________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_____________________________________________________;
②溴水溶液,现象是_____________________________________________________;
③硫化钠溶液,现象是___________________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因_____________________;验证方法__________________________。
②原因_____________________;验证方法__________________________。
③原因_____________________;验证方法__________________________。
32.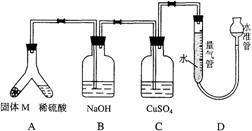 (06上海卷)(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
(06上海卷)(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式); 理由是__________________________________________________________。
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是_______。写出B装置中反应的离子方程式__________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
A M中有未反应的铁和硫
B 测定气体体积时水准管的水面高于量气管的水面
C A中留有反应生成的气体 D 气体进入D装置前未用浓硫酸干燥
31.(07重庆卷)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为__________________________。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 _________________________________;该方法的优点是____________________________________。
(3)一定温度下,1 mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p(NH3)×p(H2S) = a(Pa2),则容器中的总压为_____________Pa;
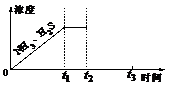
②如图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
30.(07天津卷)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O = SO42 -+2Fe2++4H+
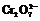 +6Fe2++14H+ = 2Cr3++6Fe3++7H2O
+6Fe2++14H+ = 2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________________。
(2)若燃烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式____________________________________________。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_________L,制得98%的硫酸质量为________t,SO2全部转化为H2SO4时放出的热量是___________kJ。
29.(07宁夏卷) 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%:
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%:
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?____________________________________ _;
(2)在400 ℃-500 ℃时,SO2的催化氧化采用常压而不是高压,主要原因是:___________________________________;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量?______(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用_________吸收SO3;
(5)已知:2SO2(g)+O2(g) = 2SO3(g);H =-196.6 kJ/mol,计算每生产1万吨98%硫酸所需要的SO3的质量和由SO2生产这些SO3所放出的热量。
28.(07上海卷)将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
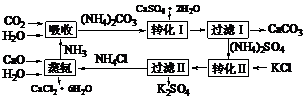
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: ________________ 。
(3)过滤I操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤I操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32 -的方法是:
。
(5)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
|
温度(℃) |
0 |
20 |
60 |
|
K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60 ℃时K2SO4的饱和溶液591 g冷却到0 ℃,可析出K2SO4晶体 g。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a.熔点较低(29 ℃熔化) b.能导电 c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:______________________________________________________________________________。
|
|
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
27.(07江苏卷)(10分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式______________________、
_________________________________________。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是___________________________________________;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为_____________;
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是______________________________。
(3)能用于测定硫酸尾气中SO2含量的是_________。(填字母)
(A)NaOH溶液、酚酞试液 (B)KMnO4溶液、稀H2SO4
(C)碘水、淀粉溶液 (D)氨水、酚酞试液
26. (07全国卷I)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ |
Mg2+ |
Al3+ |
Ba2+ |
|
|
阴离子 |
OH- |
Cl- |
CO32 - |
SO42 - |
HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是A__________;B___________;C__________;D___________;E___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com