
12.(08重庆卷)N2O2-是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
e(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为 。
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1。
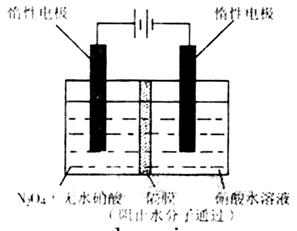
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的 区生成,其电极反应式为 。
11.(04全国卷)在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率增大的措施是( )
C(g)+D(g)正反应速率增大的措施是( )
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
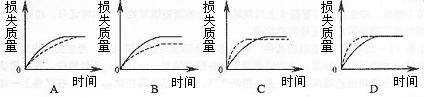
10.(04上海卷)将ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示。在相同的条件下,将bg(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
9.(04全国卷)反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
A.0.1s B.2.5s C.5s D.10s
8.(05天津卷)在密闭容器中,在一定条件下,进行下列反应:
NO(g) + CO(g)  1/2N2(g) + CO2(g);△H = -373.2 KJ/mol,达到平衡后,为提高该
1/2N2(g) + CO2(g);△H = -373.2 KJ/mol,达到平衡后,为提高该
反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
7.(05广东卷)对可逆反应4NH3(g) + 5O2
(g) ? 4NO(g) + 6H2O(g),下列叙述正确的是( )
? 4NO(g) + 6H2O(g),下列叙述正确的是( )
A、达到化学平稳时,4υ正(O2)= 5υ逆(NO )
B、若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平稳状态
C、达到化学平稳时,若增加容器体积,则正反应速率减少,逆反应速率增大
D、化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
6.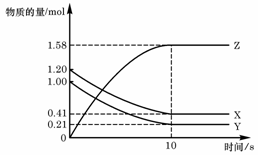 (06四川卷)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
(06四川卷)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是( )
A.反应开始到10s,用Z表示的平均反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)  Z(g)
Z(g)
5.(07北京卷)一定条件下,在体积为10 L的密闭容器中,1 mol X和1
mol Y进行反应:2X(g)+Y(g) Z(g),经60
s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60
s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的DH>0
4.(07广东卷)把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A.盐酸的浓度 B. 铝条的表面积
C.溶液的温度 D. 加少量Na2SO4
3.(08北京卷)工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com