
科目: 来源: 题型:
(1)选择题
①根据下列热化学方程式
(1)C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
(2)H2(g)+![]() O2(g)===H2O(l) ΔH2=-285.8 kJ/mol[Ks5u.com]
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol[Ks5u.com]
(3)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=-488.3 kJ/mol B.ΔH=+244.1 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
 ②右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
②右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中、d电极质量增加
D.电解过程中,氯离子浓度不变
③如下图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
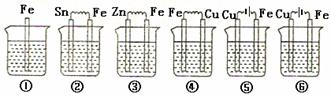
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
(2)通常人们把拆开1mol化学键所吸收的能量看成键能,键能的大小可以衡量化学键的强弱,也可以用于计算化学反应中的反应热(△H),化学反应中的△H等于反应中断裂的化学键的键能之和与反应中形成新的化学键的键能之和的差
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/KJ.mol | 360 | 436 | 431 | 176 |
工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)==Si(s)+4HCl(g),该反应的反应热△H为多少?
查看答案和解析>>
科目: 来源: 题型:
(1)选择题
①二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是 ( )
A.利用金属钠或者金属钾
B.利用质谱法
C.利用红外光谱法
D.利用核磁共振氢谱
②下列化合物的1H-NMR谱图中吸收峰数目正确的是( )

③手性分子是指在分子结构中![]() ,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
![]() A.苹果酸
A.苹果酸
B.丙氨酸
C.葡萄糖
 |
D.甘油醛
(2)仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为46,取该有机化合物样品4.6g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重5.4g和8.8g。
①求该有机化合物的分子式。
②若该有机化合物的1H核磁共振谱如下图所示,请写出该有机化合物的结构简式。

查看答案和解析>>
科目: 来源: 题型:
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表。
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数。 |
| X | 元素的原子半径是第三周期主族元素中最大的。 |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的。 |
| Z | 单质常温、常压下是气体。原子的M层上有1个未成对的p电子。 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式 。
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是 。
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是 。
(4)元素Q的原子序数是X与Z的原子序数之和。
①该元素基态原子的最外层电子排布式为 。
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4] 2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是 。
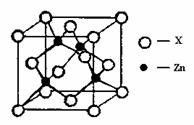
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是 (选填“甲”、“乙”、“丙”)。

查看答案和解析>>
科目: 来源: 题型:
⑴CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是 。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:第 周期,第 族,属于 区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ;葡萄糖分子中碳原子杂化方式有 。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
 | |||
 | |||
④右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物晶体的熔点比干冰 (填写“高”或“低”),原因是 。
查看答案和解析>>
科目: 来源: 题型:
A~E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |
请结合表中信息完成下列各小题:
(1)C在元素周期表中的位置是 ,D的简单阴离子的核外电子排布式为 。
(2)如图是A~E的第一电离能和电负性数据,请回答:
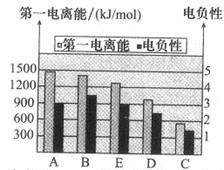
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)
。
②A、B、D三种元素的非金属性由强到弱的顺序是 。
(3)A的常见单质分子有多个共价键。
①常温下,该单质化学性质很稳定,是因为 。
②该单质分子中σ键与π键的数目之比为 。
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式
。
查看答案和解析>>
科目: 来源: 题型:
(一)下列是A、B、C、D、E五种短周期元素的某些些性质
|
| A | B | C | D | E |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3 杂化方式的是
A.![]() B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)与AD2互为等电子体的分子、离子的化学式依次为 、 (各写1种)
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是 (写分子式),理由是 ;
(二)下列是部分金属元素的电离能
| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
 (4)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为 。
(4)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为 。
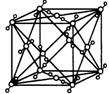
(5)CuCl用作有机合成催化剂, 并用于颜料, 防腐等工业。CuCl的晶体结构如图所示。元素Cu基态原子的电子排布式 ,与同一个Cl-相连的 Cu+有 个。
查看答案和解析>>
科目: 来源: 题型:
如图所示是一些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。

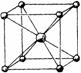
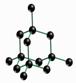

A B C D E
(1)其中代表金刚石的是 (填写编号字母),其中每个碳原子与 个碳原子最接近且距离相等,属于 晶体。
(2)其中代表石墨的是 (填写编号字母),其中每个正六边形占有的碳原子数平均为 个。
(3)其中表示NaCl的是 (填写编号字母),每个钠离子周围与它最接近且距离相等的钠离子有 个。
(4)其中表示CsCl的是 (填写编号字母),它属于 晶体,每个铯离子与 个氯离子紧邻。
查看答案和解析>>
科目: 来源: 题型:
二茂铁[(C5H5)2Fe] 分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如右图所示,下列说法正确的是( )
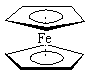 A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.1mol环戊二烯(![]() )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
C.Fe2+的价电子排布式为1s22s22p63s23p63d44s2
D.分子中存在π键
查看答案和解析>>
科目: 来源: 题型:
长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
A.第9列中元素中没有非金属元素
B.只有第二列的元素原子最外层电子排布为ns2
C.第四周期第8列元素是铁元素
D.第15列元素原子的最外层电子排布为ns2 np5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com