
题目列表(包括答案和解析)
5.下物质分类组合正确的是
A B C D
强电解质: HBr FeCl3 H3PO4 Ca(OH)2
弱电解质: HF HCOOH BaSO4 HI
非电解质: CCl4 Cu H2O C2H5OH
4. 将铜片和锌片用导线连接后插入番茄里,如右图所示,电流计指针
将铜片和锌片用导线连接后插入番茄里,如右图所示,电流计指针
发生偏转,铜片是
A.正极 B.电子流出的一极
C.发生氧化反应的一极 D.逐渐溶解
3.下列说法正确的是:( )
A.凡是放热反应都是自发的 B.铁在潮湿空气中生锈是自发过程
C.自发反应都是熵增大的反应。 D.电解池的反应是属于自发反应
2.下列电离方程式书写不正确的是

 A、2H2O H3O++OH-
B、H2S
H++HS-
A、2H2O H3O++OH-
B、H2S
H++HS-

 C、NaHS Na++HS-
D、HCO3-+H2O H3O++CO32-
C、NaHS Na++HS-
D、HCO3-+H2O H3O++CO32-
1.下列说法正确的是
A、活化分子相碰撞即可发生化学反应
B、对于吸热反应,升高温度会加快反应速率;对于放热反应,升高温度会减小反应速率
C、升高温度或者加入催化剂都能够增加活化分子的百分率从而加快化学反应速率
D、浓度增大使得反应物分子中活化分子百分率增大
28.(6分)
27.(15分)1) a的值为 △S 0(填“>”、“<”或“=”)
(2) K =______________ K值 _______________
(3)该结论 ________ 其理由是 _________________________________
(4) (5)α=
四计算题
(2)pH最小的是 c(NH4+)最小的是 (3)② ③
26.(8分)(1)该实验的目的是
(2)t2= (3)
(4)结论是
二24.(15分)(1)两眼注视 ______________________________________
溶颜色变化是 _______________________________
(2)有错误的是 _____ 测定结果_________________
有气泡结果将________________ 俯视则测定结果将______________
(3)其读数为 ____ mL
(4) _____ mol/L
24(15分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
 ① 用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
① 用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)用0.2000mol·L-1标准烧碱溶液滴定待测盐酸,选用酚酞为指示剂,滴定时两眼注视 ,直到滴入一滴标准NaOH溶液,溶液颜色变化是 , 且半分钟内不褪色时,则达到滴定终点。
(2)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”,下同)__________________
步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果_________________
若步骤⑤中读数时俯视,则测定结果将______________
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL
(4)改正错误后,根据下列数据:请计算待测盐酸溶液的浓度: mol/L
|
滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.40 |
20.40 |
|
第二次 |
20.00 |
4.00 |
24.00 |
|
第三次 |
20.00 |
2.00 |
24.10 |
25 (10分).在常温下,下列四种溶液:
① 0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4 ④ 0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈_________,其原因是 (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
26 (8分). “碘钟”实验中,3I- +S2O82- ==I3- +2SO42- 的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大,某探究学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
C(I-)/ mol/L |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
C(S2O82-)/ mol/L |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应速率影响符合一般规律,若在40℃下进行编号③对应浓度实验,显色时间t2的范围为 (填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
27.(15分)一定温度下,在体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+ Y(g) 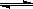 a Z(g) +
W(g) △H =-QkJ/mol (Q>0)
a Z(g) +
W(g) △H =-QkJ/mol (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1) 化学计量数a的值为 ,该反应的熵变△S 0(填“>”、“<”或“=”)
(2) 平衡常数K表达式=_______________温度升高平衡常数K的值将 _______________(填“增大”“减小”或“不变”
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确? ,其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2molX、1molY、1molAr B.a molZ、1mol W
C.1molX,0.5molY,0.5amolZ,0.5 mol W ;D.4 molX、2mol Y
(5) X的转化率α= (用含Q、Q1的代数式)
四计算题
28(6分).常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液与pH=3的某一元弱酸溶液20ml恰好完全反应,消耗了NaOH溶液13ml,试求:
(1)NaOH溶液的物质的量浓度。
(2)此一元弱酸的物质的量浓度。
(3)求此条件下该一元弱酸的电离平衡常数。
 台州中学2009-2010学年第二学期期中试题答题卷
台州中学2009-2010学年第二学期期中试题答题卷
高二 化学
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com