
题目列表(包括答案和解析)
25. 根据化学平衡知识,判断下列说法正确的是( )
A.在Na2S溶液中存在下列关系:c(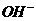 )=c(HS-)+c(H+)+c(H2S)
)=c(HS-)+c(H+)+c(H2S)
B.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
C.25℃时,在浓度均为1mol·L-1的(NH4)2SO4 、(NH4)2CO3
、(NH4)2Fe(SO4)2的溶液中,测得其中c(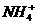 )分别为a、b、c(mol·L-1),则有 a>b>c
)分别为a、b、c(mol·L-1),则有 a>b>c
D.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
24.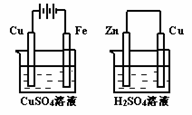 右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上析出物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;
|
|
D.溶液的pH:①不变;②增大
23.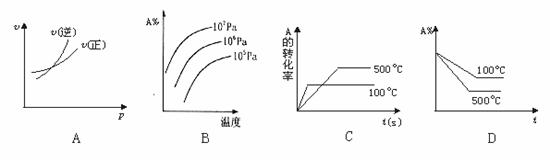 对于可逆反应A(g)+2B(g)
对于可逆反应A(g)+2B(g)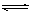 2C(g) ΔH﹥0,下列图象中正确的是( )
2C(g) ΔH﹥0,下列图象中正确的是( )
22.下列描述违背化学原理的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.反应A(g)+3B(g) 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
D.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”,充电时标“+”接线柱接外电源的正极,标“-”接线柱接外电源的负极
21.pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H+浓度为(单位:mol·L-1)
A、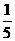 ×(4×10-9+1×10-12)
B、
×(4×10-9+1×10-12)
B、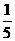 ×(8×10-9+1×10-12)
×(8×10-9+1×10-12)
C、5×10-10 D、5×10-12
20.常温下,0.1mol·L-1某一元酸(HA)溶液中水电离出来的c(H+)为1×10-11 mol·L-1,下列叙述正确的是( )
A.该一元酸溶液的pH=1
B.该溶液中HA的电离度为 1% C.该溶液中水的离子积常数为1×10-22 D.若加水稀释,则C(OH-)/C(H+)将减小
19.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的( ) A. 滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- B. 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ C. 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ D. pH=1的溶液 Cu2+、Na+、Mg2+、NO3-
18.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
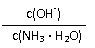
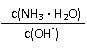
A. B.
C. c(H+)和c(OH-)的乘积 D.OH-的物质的量
17.液氨与水的电离相似,存在着微弱的电离:2NH3≒NH4++NH2-。对该体系的说法中错误的是
A 、一定温度下,液氨中c(NH4+)与c(NH2-)的乘积为一常数;
B、液氨的电离达到平衡时,c(NH3)=c(NH2-)=c(NH4+);
C、只要不加入其他物质,液氨中c(NH4+)总是与c(NH2-)相等;
D、液氨中含有NH3、NH4+和NH2-等微粒。
16.某温度下,反应N2
(g)+3H2 (g) 2NH3(g);△H
<0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有( )
2NH3(g);△H
<0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有( )
A.保持容器的容积不变,升高了温度
B. 保持容器压强和温度不变,向容器内补充了Ar(g)
C.保持容器容积和温度不变,向容器内补充了N2
D.保持容器容积和温度不变,液化分离走部分NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com