
题目列表(包括答案和解析)
23.(8分)已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______。
A. 一定向正反应方向移动 B. 一定向逆反应方向移动
C. 一定不移动 D. 不一定移动
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达到平衡时,C的体积分数为_______;容器的容积为_______。
22.(10分)用实验确定某酸HA是弱电解质。两同学的方案是: 甲:①称取一定质量的HA配制0.l mo1·L-1的溶液100mL; ②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。 乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL; ②分别取这两种溶液各10mL,加水稀释为100mL; ③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。 (1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=) 乙方案中,说明HA是弱电解质的现象是 (多选扣分) (a)装HCl溶液的试管中放出H2的速率快; (b)装HA溶液的试管中放出H2的速率快; (c)两个试管中产生气体速率一样快。 (3)请你评价:乙方案中难以实现之处和不妥之处 、 (4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
21.(8分)反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
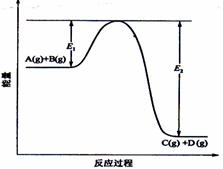
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。*k*s*5u
20.向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-)。其平衡关系如下:
Cr3++3OH-====Cr(OH)3====CrO22- + H+ + H2O
(紫色) (灰绿色) (亮绿色)
向0. 05mo1·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是( )
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断*k*s*5u
19.一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是 ( )
A.加入的碱过量 B.生成的盐发生水解
C.反应后溶液中c(A-)= c(M+) D.混合前酸与碱中溶质的物质的量相等
17.目前市场上的手提应急灯,主要是“无液干粉”铅酸蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是铅─二氧化铅─硫酸。下列关于该铅酸蓄电池的说法正确的是( )
A.充电时电源的正极接蓄电池标“+”的一极
B.“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理
C.放电时在铅酸蓄电池的负极发生还原反应
D.充电时电池上标有“-”的极发生氧化反应
18 .某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
A.反应速率a>b>c
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是吸热反应
D.达到平衡时,AB3的物质的量大小为:c > a > b
16.某溶液中存在的离子有:Na+,H+,S2-,HS-,OH-,则下列有关对该溶液叙述错误的是( )
A.离子浓度可能是C(Na+)>C(S2-)>C(OH-)>C(HS-)>C(H+)
B.组成该溶液的溶质只能是Na2S或NaHS或两者的混合物
C.离子物质的量的关系是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+)
D.该溶液可能是中性,或碱性,或酸性
15.在二氧化碳的水溶液中存在着如下平衡:
C02(g)  C02(aq)
C02(aq)+H20
C02(aq)
C02(aq)+H20 H2C03(aq)
H2C03(aq)
H2C03(aq)
 H+ (aq)+HCO3-(aq)
HCO3-(aq)
H+ (aq)+HCO3-(aq)
HCO3-(aq)
 H+(aq)+CO32-(aq)
H+(aq)+CO32-(aq)
下列有关说法正确的是 ( )
A.水中溶解的二氧化碳的浓度,夏天时比冬天时高
B.如果海水略呈碱性,海水中二氧化碳的浓度比纯水高
C.气压升高,水中c(HCO3-)增大
D.常温下,二氧化碳的水溶液中,由水电离出的c(H+)与c(OH-)的乘积等于1×lO-14
14.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)== SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)== SnCl2(aq)+H2(g) ΔH2
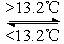
③Sn(s,灰) Sn(s,白) ΔH3 = +2.1 kJ·mol-1
下列说法正确的是( )
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在*k*s*5u
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏
13.常温下取2个浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为( )*k*s*5u
A.0.01 mol•L-1 B.0.017 mol•L-1
C.0.05 mol•L-1 D.0.50 mol•L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com