
题目列表(包括答案和解析)
2.实验表明,液态时,纯硫酸的导电性强于纯水。已知液态电解质都能像水那样自身电离而建立电离平衡(即像H2O+H2O=H3O++OH-那样),且在一定温度下都有各自的离子积常数。问在25℃时,纯硫酸的离子积常数K和水的离子积常数KW关系为 ( )
A.K>KW B.K=KW C.K<KW D.无法比较
1.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 ( )
A.氯化钠 B.固体硝酸铵 C.固体氢氧化钠 D.生石灰
30.(9分)⑴33.33﹪(3分)
⑵Y的速率为0.01 mol/(L·min)(3分)
⑶n =1(3分)
29. (14分)⑴0.1(2分) ⑵0.75(3分)
⑶①a (2分) ②参看右图(2分)
⑷ A、B (3分) ⑸B、D(2分)
28.(8分)⑴ 不移动 不变 (2分)
⑵ 向左 变大(2分)
⑶ 不移动 不变(2分)
⑷ 向右 变小(2分)
27.
 (9分)①2.00 (1分)
②2.25 (2分) 0.50(2分)
(9分)①2.00 (1分)
②2.25 (2分) 0.50(2分)
③2Z+X=1(2分) Y+3/2Z=3(2分)
30.(9分)把0.6molX气体和0.4molY气体混合于2L密闭容器中,使他们发生如向下的反应:
2X(g)+Y(g) nZ(g)+2W(g),5min末生成 o.2molW 。若测知以Z的浓度变化来表示的平均反应速率为0.01 mol/(L·min),则
nZ(g)+2W(g),5min末生成 o.2molW 。若测知以Z的浓度变化来表示的平均反应速率为0.01 mol/(L·min),则
⑴ X气体的转化率;⑵求Y的反应速率;⑶求化学计量数n的值。
29.(14分)在某个容积为2.0L的密闭容器中,在T℃时按下图1所发生的反应:
mA(g)+nB(g)  p D(g)+ qE(s) △H﹥0(m,n,p,q为最简整数比)
p D(g)+ qE(s) △H﹥0(m,n,p,q为最简整数比)
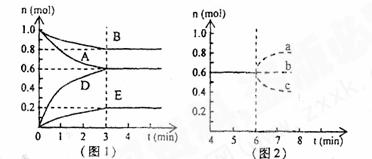
(1) 图1所示,反应开始时至达到平衡时,用D表示的平均反应速率为________mol/(L·min)
(2)
 T℃时该反应的化学平衡常数K的数值为________
T℃时该反应的化学平衡常数K的数值为________
(3) 反应达到平衡后,第6min时:
① 若升高温度,D的物质的量变化曲线最可能的是_______(用图2中的a-c的编号做答);
② 若在6min时仍为原平衡,此时将容器的容积压缩为原来的一半,请在答卷图3中画出6min后B浓度的变化曲线
(4) 在T℃时,相同容积中,若反应开始时按以下方式加入各物质,达到平衡后,A的物质的量浓度与原来相同,下列各项中,符合要求的有_______
A 0.4molA+0.7molB+0.9molD+0.3molE
B 0.6molA+0.8molB+0.6molD+0.5molE
C 1.5molD+0.5molE
D 0.5molA+0.5molB+1.2molD+0.4molE
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是( )
A 化学反应速率理论可以指导怎样在一定时间内快出产品
B 有效碰撞理论可以指导怎样提高原料的转化率
C 勒夏特列原理可以指导怎样使有限原料多出产品
D 催化剂的使用是提高产品产率的有效办法
E正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
28.(8分)在密闭容器中进行下列反应:CO2+C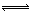 2CO达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化?
2CO达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化?
(1)增加固体C,平衡_________C(CO)_________
(2)减小密闭容器的容积,保持温度不变,则平衡_____ _ ___ C(CO2)____ _____
(3)通入N2,保持密闭容器的容积和温度不变,则平衡_____ ____C(CO)____ __
(4)通入N2,增大密闭容器的容积,保持温度不变则平衡_______ __ C(CO2)___ __ ____
27.(9分)某温度下,向体积不变的容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com