
题目列表(包括答案和解析)
30.(13分)
(1)_____________________________,_______________________;_____________________。
(2)______________,___________________________________________.
(3)___________, ______________________(写化学式)
(4)______________________
(5)______________________(写化学式)。
29.(13分) (1)_____________________ ___________________ (用化学式作答)
(2) ___________________
(3)______________________________________________________________________
____________________________________________________________________。
(4)_________和__________, __________
(5) __________________________________________________________________________。
28.(13分)(1)_______< ________ <_______(填元素符号)
(2)_________________________________
(3)_____________________ (4) ________
(5)_______________________________________________________
(6) _________________.
27.(3分)将金属的密堆积型式、对应的晶胞及其实例进行连线。
密堆积型式 晶胞类型 实例
A1 体心立方 Mg
A2 六方 Cu
A3 面心立方 K
26.(4分)
(1)_________________________________________________________________________
(2) ______________ __________
25.(6分)写出下列微粒的电子排布式和电子轨道表示式。
(1)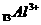 ____________________________ ________________________________
____________________________ ________________________________
(2)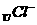
 ____________________________
____________________________________
____________________________
____________________________________
(3)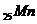 ____________________________
____________________________________
____________________________
____________________________________
30.(13分)元素A、B、C都是短周期元素,A元素原子的2p轨道上有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期元素中电负性最大的。试回答:
(1)A原子的轨道表示式为______________________,B的电子排布式为______________;C的价电子排布式为___________________
(2)它们的气态氢化物中最稳定的是(写化学式)______________,A的气态氢化物在空气中燃烧的化学方程式为______________________。5U.C#O%
(3)它们的最高价氧化物的水化物中酸性最强的是 ___________,最弱的是__________(写化学式)
(4)BC4的电子式是___________
(5)单质能形成原子晶体的是___________(写化学式)。K^S*5U.C#O%
华昌中学2009-2010学年下学期期中考高二化学答题卷
29.(13分)X、Y、Z、W是原子序数依次增大的前四周期元素,已知:
①X元素原子的最外层电子数是次外层的2倍;
②Y元素原子的P轨道上有2个未成对电子;
③Z元素在同一短周期元素中的原子半径最大;
④W元素原子的核外最外层电子数与Z相同,其余各电子层均充满电子。K^S*5U.C#O%
(1)X、Y、Z的I1从小到大的顺序_____________________
X、Y电负性较小的是___________________ (用化学式作答)
(2)W元素的价电子排布式是___________________
(3)Z的氢化物熔点比Y的氢化物熔点高,原因是_______________________________________
________________________________________________________________________。
(4)X的一种氢化物的相对分子质量为42,分子中含有 和
和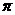 键的个数比为8:1,则该分子中X的杂化类型是_________和__________,分子中所有原子能否处于同一平面?__________
键的个数比为8:1,则该分子中X的杂化类型是_________和__________,分子中所有原子能否处于同一平面?__________
(5)Y的简单氢化物可以和W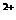 形成配位键,而X的简单氢化物则不行,原因是________________________________________________________________________。K^S*5U.C#O%
形成配位键,而X的简单氢化物则不行,原因是________________________________________________________________________。K^S*5U.C#O%
28.(13分)已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的2倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:K^S*5U.C#O%
(1)X、Y、Z第一电离能由小到大的顺序为_______< ________ <_______(填元素符号)
(2)E元素基态原子的电子排布式为_________________________________
(3)X和Z形成有毒气体XZ,实验室常用EQ溶液吸收并定量测量XZ的含量。反应时,XZ与EQ形成配合物的分子中原子间成键关系如图1所示:K^S*5U.C#O%
E+和XZ之间的化学键类型是_____________________
(4)XZ2分子中含有________个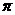 键。
键。
(5)Z氢化物的沸点比Q氢化物的沸点高,理由是____________________________________
(6)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示(白球位于立方体的顶点和体心,小黑球位于立方体的面心),该化合物中X60与钾原子个数比为_________________ K^S*5U.C#O%
K^S*5U.C#O%
27.(3分)将金属的密堆积型式、对应的晶胞及其实例进行连线。K^S*5U.C#O%
密堆积型式 晶胞类型 实例
A1 体心立方 Mg
A2 六方 Cu
A3 面心立方 K
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com