
题目列表(包括答案和解析)
25、(12分)某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
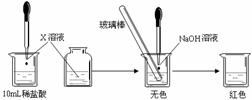 Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
则X溶液是 ▲ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
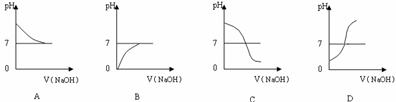
①写出测定溶液pH值的操作方法: ▲ ;
②上图中哪个图像符合该同学的记录 ▲ (填序号)。高*考*资*源*网
(3)你认为甲、乙两位同学的实验中, ▲ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:
▲ 。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取
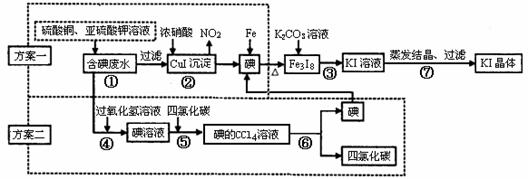
24、(7分)某研究性学习小组拟从海带处理后的含碘废水中进行回收碘,制订两种方案提取,其实验方案如下,试回答以下问题:
高*考*资*源*网
高*考*资*源*网
(1)方案一中步骤②的化学反应方程式 ▲ 。
(2)方案二中用H2O2溶液而不用氯气,其理由是 ▲ 。
(3)方案二中步骤⑥的名称是 ▲ 。
(4)步骤⑦用到的仪器,除酒精灯、三脚架、蒸发皿、坩锅钳、滤纸、火柴等外,还缺少的玻璃仪器有 ▲ (填两种)。高*考*资*源*网
23、(14分) 对于反应A(g) 2B(g) DH>0,在温度为T1、T2时,平衡体系中B的体
2B(g) DH>0,在温度为T1、T2时,平衡体系中B的体
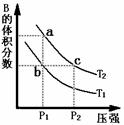 积分数随压强变化的曲线如图所示。回答下列各题。高*考*资*源*网
积分数随压强变化的曲线如图所示。回答下列各题。高*考*资*源*网
(1)根据曲线图,分析下列说法正确的是 ▲ (填字母) 。
A.a、c两点的反应速率:a 〉c
B.由状态b到状态a,可以通过加热的方法
C.b、c两点A气体的转化率相等
(2)上述反应在密闭容器(定容)中进行,达到平衡状态的标志是 ▲ (填字母) 。
A.单位时间内生成n mol A的同时分解2n molB
B.两种气体的体积分数不再改变高*考*资*源*网
C.v正(A)=2v逆(B)
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1 mol·L-1 ,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度 ▲ 0.1 mol·L-1(填“〉”、“〈”或“=”) 。
(4)在100℃时,将0.40mol的B气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
|
时间(s)
|
0 |
20 |
40 |
60 |
80 |
|
n(B)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(A)/mol |
0.00 |
0.05 |
n2 |
0.08高*考*资*源*网 |
0.08 |
① 在上述条件下,从反应开始至40s时,以A气体表示的该反应的平均反应速率为 ▲ ;
② 上表中n3 ▲ n4(填“〉”、“〈”或“=”),反应A(g) 2B(g)在100℃时的平衡常数K的值为
▲ ,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为
▲ ,升高温度后,反应2B(g)  A(g)的平衡常数K的值 ▲ (填“增大”、“减小”或“不变”);
A(g)的平衡常数K的值 ▲ (填“增大”、“减小”或“不变”);
③ 若在相同情况下最初向该容器中充入的是A气体,要达到上述同样的平衡状态,A气体的起始浓度为 ▲ mol·L-1 。高*考*资*源*网
22、(11分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
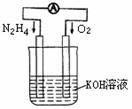 (1)发射卫星时可用肼(N2H4)作燃料,其方程式为:
(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:
N2H4+O2=N2+2H2O,若将此反应设计成如右图所示的原电
池装置,请回答:
①负极反应式为: ▲ ;高*考*资*源*网
②工作一段时间后正极附近溶液的pH变化为 ▲
(填“增大”“减小”或“不变”) ;高*考*资*源*网
③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时
间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为 ▲ 。
(2)在25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2 混合溶液中逐滴加入氨水,
首先生成 ▲ 沉淀(填化学式),生成该沉淀的离子方程式为 ▲ 。(已知25℃ Ksp[Mg (OH)2]=1.8×10-11,Ksp[Cu (OH)2]=2.2×10-20)。
(3)在25℃时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)= c (Cl-),则溶液显 ▲ 性(填“酸”“碱”或“中”),用含a的代数式表示NH3· H2O的电离常数kb= ▲ 。高*考*资*源*网
21、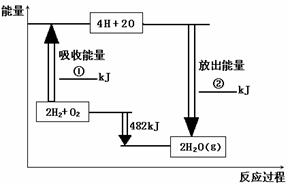 (8分)已知拆开1mol氢气中的化学键需
(8分)已知拆开1mol氢气中的化学键需
要消耗436kJ能量,拆开1mol氧气中
的化学键需要消耗498kJ能量,根据
右图中的能量图,回答下列问题:
(1)分别写出①②的数值:
① ▲ ;
② ▲ 。高*考*资*源*网
(2)生成H2O(g)中的1mol H-O键放出 ▲ kJ的能量。
(3)已知:H2O(l)= H2O(g) DH = +44 kJ·mol-1 ,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式: ▲ 。
20、完全燃烧一定质量的无水甲醇生成CO2 和水蒸气放出热量为Q,已知为了完全吸收生成的CO2,消耗8mol·L-1NaOH溶液50mL,则完全燃烧1mol无水甲醇产生CO2气体和液态水放出的热量不可能是
A. 5Q B. 小于2.5Q C. 大于5Q D. 2.5Q -5Q
19、下列各溶液中,微粒的物质的量浓度关系不正确的是高*考*资*源*网
A.0.1 mol·L-1NaHCO3溶液中: c (H2CO3) > c (CO32-)
B.0.1 mol·L-1Na2CO3溶液中:c (Na+)=2 c (CO32-)+ 2 c (HCO3-)+2c (H2CO3)
C.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合,其混合溶液中:
c (Cl-) > c (NH4+ ) > c (Na+ ) > c (OH-) >c (H+)
D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HCO3溶液的pH大小顺序:
pH (CH3COONH4) > pH (NH4HCO3) > pH (NH4Cl) 高*考*资*源*网
18、 在固定体积的密闭容器中,发生:N2(g)+3H2(g) 2NH3(g) DH=-92.2 kJ·mo1-1 ,
2NH3(g) DH=-92.2 kJ·mo1-1 ,
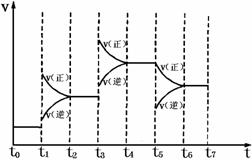 右图表示在时间t0-t7中反应速率与反应过
右图表示在时间t0-t7中反应速率与反应过
程的曲线图,则容器内氨的百分含量最高的
一段时间是(只改变单一的条件)
A. t0-t1
B. t2-t3
C. t4-t5
D. t6-t7
17、下列实验操作正确的是
A.纸层析法分离铁离子和铜离子的实验中,应将滤纸上的试样点浸入展开剂中
B.硝酸钾晶体的制备实验中,蒸发浓缩硝酸钠和氯化钾的混合溶液,氯化钠晶体析出后趁热过滤,承接滤液的烧杯应预先加蒸馏水,以防降温氯化钠溶液达饱和而析出
C.海带中碘元素的分离及检验的实验中,将海带灰用蒸馏水浸泡,煮沸2-3 min,取其浸取液,向其中加入四氯化碳萃取其中的碘高*考*资*源*网
D.乙醇的脱水反应(制乙烯)实验中,反应的温度应控制在170℃,温度计的水银球应处于支管口处
16、下列离子方程式书写错误的是
A.氧化铝溶于强碱溶液中:3H2O+Al2O3+2OH-=2Al(OH)4-
B.在苯酚钠溶液中通入CO2气体:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
C.用惰性电极电解硫酸铜溶液:2Cu2++2H2O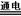 2Cu+O2↑+4H+高*考*资*源*网
2Cu+O2↑+4H+高*考*资*源*网
D.在海带中提取碘元素时,在滤液中加入适量的稀硫酸和双氧水:2H++2I-+H2O2=I2+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com