
题目列表(包括答案和解析)
2.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
1.下列说法正确的是( )
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
22.(10分)如图Ⅰ,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(?)+B(?) x C(g);ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
x C(g);ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
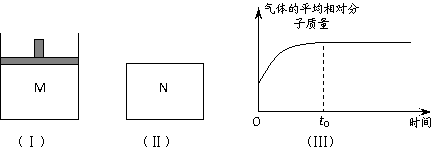
⑴根据题中数据计算,x =_________、y =_________;
⑵如图Ⅱ,在体积为V L的恒容密闭容器N中加入和M中相等的A和B发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ,平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,所以z和y的大小也不确定。现根据下表中A、B的状态,请完成z与y的大小关系及M(B)与M(C)的大小关系:
|
可能的情 形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系 |
|
|
A |
B |
|||
|
① |
是 |
不是 |
|
无法比较 |
|
② |
是 |
是 |
|
无法比较 |
|
③ |
不是 |
是 |
z < y |
|
21.(10分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
|
实验编号 |
C(HA) (mol·L-1) |
C(NaOH) (mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH > 7 |
|
丁 |
0.1 |
0.1 |
pH=8 |
(1).不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________ ___________________________________。
(2).不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2__ ___(填“是”或“否”)。
(3).丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中c(Na+) 、c(A-) 和c(HA) 的浓度由大到小的顺序是____________ ____________________。
(4).写出丁组实验所得混合溶液中下列算式的精确结果(不能作近似计算): c(Na+)与c(A-)的浓度差为_____ ___mol·L-1
20. (14分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测
(14分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测
硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述
稀H2SO4 25.00mL(酚酞作指示剂),滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,滴入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”
以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写);E→C→D→ → → →F;
②在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“不变”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用0.1mol/L的NaOH溶液,原因是______________ _____ ___。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度 (选填“偏大”“偏小”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)的物质的量浓度(保留到小数点后二位) 。
19.(6分)把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是 。
(3)煤炭作为燃料采用途径II的优点有 。
18.(8分)下列反应在210℃达到平衡:
PCl5(g) PCl3(g)+Cl2(g) △H >0 K=1
①
PCl3(g)+Cl2(g) △H >0 K=1
①
CO(g)+Cl2(g) COCl2(g) △H <0 K=5×104 ②
COCl2(g) △H <0 K=5×104 ②
COCl2(g) CO(g)+
Cl2(g) △H >0
③
CO(g)+
Cl2(g) △H >0
③
(1)化学平衡常数K表示可逆反应的进行程度,K值大小与温度的关系是:温度升高,K值_______ ___________(填一定增大、一定减小、或可能增大也可能减小)。
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是
A.c(PCl5) = c(PCl3)= c(Cl2)=1 B.c(PCl5)= c(PCl3)·c(Cl2)=1 C.c(PCl5)= c(PCl3)·c(Cl2)
反应②和反应③的K值表达式 (填“相同”或“不同”)
(3)降低Cl2浓度,反应③的K值 ____ (填“增大”、“减少”或“不变”)。
17.(4分)在下列事实中,什么因素影响了化学反应速率:
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:__________________。
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:_____________________。
(3)同浓度、同体积的盐酸中分别放入同样大小的锌粒和镁条,产生气体有快有慢:
___________________________________。
(4)夏天的食品易变质,而冬天不易发生该现象:________________________。
16.常温下pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为 ( )
A.1:9 B.1:11 C.9:1 D.11:1
第Ⅱ卷 非选择题(共52分)
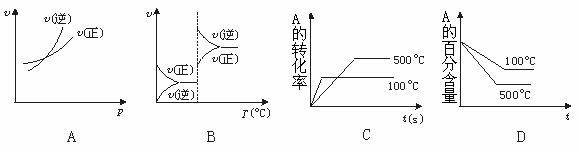
15.对于可逆反应A(g)+2B(g)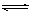 2C(g)
△H>0,下列图象中正确的是( )
2C(g)
△H>0,下列图象中正确的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com