
题目列表(包括答案和解析)
13.将2.0molSO2和1.0molO2充入到体积不变的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g),达平衡时,SO3为0.40mol。如果此时移走1.0mol SO2和0.50molO2,在相同温度下再次达到平衡,则下列有关说法正确的是
( )
2SO3(g),达平衡时,SO3为0.40mol。如果此时移走1.0mol SO2和0.50molO2,在相同温度下再次达到平衡,则下列有关说法正确的是
( )
A.新平衡时SO3的物质的量为0.20mol B.新平衡时SO3的物质的量小于0.20mol
C.原平衡时SO2的转化率为40% D.新平衡的平衡常数将减小
12.已知:2SO2(g)+O2(g) 2SO3(g);ΔH<0。在不同温度(T1和T2)及压强(P1和P2)下,产物SO3的物质的量(n)与反应时间(t)的关系如图所示。下列判断正确的是( )
2SO3(g);ΔH<0。在不同温度(T1和T2)及压强(P1和P2)下,产物SO3的物质的量(n)与反应时间(t)的关系如图所示。下列判断正确的是( )
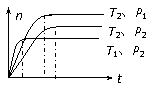 A.T1>T2,P1>P2
A.T1>T2,P1>P2
B.T1<T2, P1>P2
C.T1<T2, P1<P2
D.T1>T2,P1<P2
11.在一定温度下,在容积为10L的密闭容器中,1molSO2和1molO2进行反应:2SO2(g)+O2(g) 2SO3(g),经30s达到平衡,生成0.3 mol SO3,下列说法正确的是 ( )
2SO3(g),经30s达到平衡,生成0.3 mol SO3,下列说法正确的是 ( )
A.以O2的浓度变化表示的反应速率为0.001mol·L-1·s-1
B.将容器体积变为20L,SO3的平衡浓度将变为原来的二分之一
C.若升高温度时,SO2的体积分数增大,则该正反应的ΔH<0
D.若增大压强,则SO2、O2的转化率均减小
10.已知反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-200kJ/mol。当有4molSO2参加反应时,共放出319.6kJ热量时,则SO2的转化率最接近于
( )
2SO3(g),ΔH=-200kJ/mol。当有4molSO2参加反应时,共放出319.6kJ热量时,则SO2的转化率最接近于
( )
A.40% B.50% C.80% D.90%
9.对于可逆反应:2SO2(g)+O2(g) 2SO3(g),在体积固定的密闭容器中反应,下列能够说明该反应达到化学平衡状态的标志是
( )
2SO3(g),在体积固定的密闭容器中反应,下列能够说明该反应达到化学平衡状态的标志是
( )
A.单位时间内生成n molO2的同时,生成2n mol SO3
B.用SO2、O2、SO3表示的反应速率之比为2∶1∶2的状态
C.混合气体的质量不再变化的状态
D.混合气体的密度不再变化的状态
8.对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列变化可增大活化分子百分数而使反应速率加快的是:①增大压强;②升高温度;③增大O2浓度;④使用催化剂 ( )
2SO3(g),下列变化可增大活化分子百分数而使反应速率加快的是:①增大压强;②升高温度;③增大O2浓度;④使用催化剂 ( )
A.①③ B.①④ C.②③ D.②④
7.下列溶液一定呈碱性的是 ( )
A.溶液中c(OH-) >c(H+) B.溶液中含有OH-离子
C.滴加甲基橙后溶液呈黄色 D.水电离出的c(H+)=10-9mol/L的溶液
6.醋酸(CH3COOH)的下列性质中,不能证明它是弱电解质的是 ( )
A.0.1mol/L醋酸溶液的pH=3
B.醋酸能与水以任意比互溶,且与Na2CO3溶液反应有CO2气体产生
C.常温下,醋酸钠溶液的pH>7
D.相同条件下,1mol/L醋酸溶液的导电性与0.01mol/LHCl溶液的导电性相当
5.已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量;②1molCl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。则下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学反应式是H2(g)+Cl2 (g)=2HCl(g)
B.氢气与氯气反应生成2molHCl气体,反应的ΔH=183kJ/mol
C.氢气与氯气反应生成2molHCl气体,反应的ΔH=-183kJ/mol
D.氢气与氯气生成氯化氢的反应是放热反应,在常温常压下就能自发进行
4.下列关于判断过程方向的说法正确的是 ( )
A.所有自发进行的化学反应都是放热反应
B.同一物质在固、液、气三种状态的熵值相同
C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.非自发反应在任何条件下都不能进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com