
题目列表(包括答案和解析)
7.对已达化学平衡的下列反应: 2X(g)+Y(g)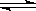 2Z(g)减小压强时,对反应产生的影响是( )
2Z(g)减小压强时,对反应产生的影响是( )
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
6.碳酸铵在室温下就能自发地分解产生氨气,对其说法中正确的是( )
A碳酸铵分解是因为生成易挥发的气体,使体系的熵增大
B碳酸铵分解是因为外界给予了能量
C碳酸铵分解是吸热反应,根据能量判据不能自发分解
D碳酸盐都不稳定,都能自发分解
5.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )
A. C + H2O == CO + H2 ΔH= +131.3 kJ·mol-1
B. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +10.94 kJ·mol-1
C. C(s)+ H2O(l) == CO(g) + H2(g) ΔH= +131.3 kJ·mol-1
D. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +131.3 kJ·mol-1
4.下列说法正确的是( )
A.需加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件一定能发生反应条件
C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应
D.当△H<0时表明反应为吸热反应
3.下列说法正确的是 ( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值、单位,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
2.下列说法不正确的是( )
A.能够发生有效碰撞的分子叫做活化分子
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大.化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
1.下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
21.有一硫酸和硝酸的混合溶液,取出20 mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32 g;滤液与4 mol/L的NaOH溶液35 mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度?
(2)另取20mL原溶液,加入3.2 g铜粉共热,生成气体一氧化氮的体积(标准状况)?
南充高中2012级第三学期第一次阶段性考试
20.(11分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
|
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20.5% |
 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
观察外观:该硫酸铵化肥无可见机械性杂质。
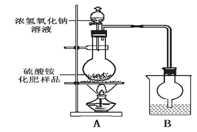
实验探究:按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:
_____________________________________,烧杯中盛放
的试剂最好是__________(填“浓硫酸、稀硫酸或水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
。
问题讨论:
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是 ;乙同学:实验装置中还存在另一个明显缺陷是 ______。经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
探究结论:称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是或不是”)一等品。
19.(8分)已知Mg和稀HNO3反应,还原产物是N2O;若HNO3极稀,则还原产物为NH3,并与过量HNO3反应生成NH4NO3。现有9.6 g Mg与1 L 1.1 mol/L的稀 HNO3(过量)充分反应后收集到a mL气体(标准状况),同时测得c(NH4+)=0.08mol/L(设反应前后溶液体积不变)。求:
(1)a= ; (2)有 mol HNO3被还原;
(3)反应后溶液的c(H+)= mol/L; (4)反应后溶液中c(NO3-)= mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com