
题目列表(包括答案和解析)
21、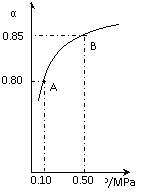 (每空2分共12分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(每空2分共12分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)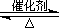 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。
③平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g)+2H20(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
20、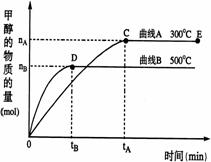 (每空2分共8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(每空2分共8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)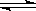 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式
K= ,升高温度,K值
(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
19、(每空2分,共12分)化学反应A(g)+B(g)  C(g)+D(g)ΔH<0,850℃时,K=l. t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
C(g)+D(g)ΔH<0,850℃时,K=l. t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
t℃时物质的浓度(mol·L-1)变化
|
时间/min |
A |
B |
C |
D |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
(1)计算t℃该化学反应的平衡常数:
(2)t℃ 850℃(填大于、小于或等于)。判断依据是
(3)反应在4min-5min之间,平衡 (填“向左”、“向右”或“不”)移动,可能的原因是
a.增加A的浓度 b.增加D的浓度 c.增加C的浓度 d.使用催化剂
(4)某温度下反应C(g)+D(g)
 A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
18、(12分)在500℃时,2SO2+O2  2SO3
(正反应是放热反应)的平衡体系中,若改变下列条件,请把影响结果填入下表中。
2SO3
(正反应是放热反应)的平衡体系中,若改变下列条件,请把影响结果填入下表中。
|
改变条件 |
正反应速率 |
对平衡的影响 |
SO2的转化率 |
|
(1)增大SO2的浓度 |
|
|
|
|
(2)同等倍数增大各物质的浓度 |
|
|
|
|
(3)升高温度 |
|
|
|
|
(4)体积不变,充入氩气 |
|
|
|
17、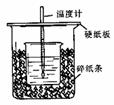 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应, 与上述实
验相比,所测出的中和热 (填“相等、不相等”),原因是 。
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
16、下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.合成氨工厂通常采用20 MPa--50 MPa压强,以提高原料的利用率
B.合成氨工业中使反应温度达到500℃利于氨的合成。
C.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
D.阴暗处密封有利于氯水的储存
15、反应 A+B → C 的反应速率方程式为:v = k c (A) c (B), v为反应速率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
14、已知25℃、101kPa条件下:
①4Al(s)+3O2(g)==2Al2O3;△H=-2834.9kJ•mol-1 ②4Al(s)+2O3(g)==2Al2O3;△H=-3119.1kJ•mol-1
由此得出的正确结论是 A.等质量的O2比O3能量低,由O2变O3为吸热反应 B.反应①可确定铝的燃烧热是708.7KJ
C.O3比O2稳定,由O2变O3为放热反应 D.反应②可确定铝的燃烧热是779.78 kJ•mol-1
13、某温度下在密闭容器中发生如下反应:2SO2+O2 2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
A.20% B.40% C.50% D.60%
12、已知在101kPa时:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-820kJ/mol。下列说法中正确的是
 A、反应过程中能量关系可用右图表示
A、反应过程中能量关系可用右图表示
B、CH4的燃烧热是820kJ
C、11.2LCH4完全燃烧放出热量410kJ
D、若将此反应设计成原电池,甲烷在正极被氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com