
题目列表(包括答案和解析)
4.在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)  2C(g),可以判断达到化学平衡状态的是( )
A.体系压强不变
B.单位时间消耗n molA,同时生成2nmolC
C.A的转化率不变 D.容器内气体密度不变
2C(g),可以判断达到化学平衡状态的是( )
A.体系压强不变
B.单位时间消耗n molA,同时生成2nmolC
C.A的转化率不变 D.容器内气体密度不变
3.分别加热蒸干并灼烧(低于400℃)下列溶液,可以得到相应溶质的是 A.氯化铜溶液 B.硫酸亚铁溶液 C.碳酸氢钠溶液 D.硫酸铝溶液
2.在2L密闭容器中,发生3A(g)+B(g) ==2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/(L·s),则10秒钟后容器中B的物质的量为( )
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
1.下列物质属于电解质的是( )
A.Cu B.Na2O2固体 C.液态NH3 D.稀硫酸
26.(6分)某温度下H2(g)+I2(g)
 2HI(g)的平衡常数是50,在该温度下只充入H2与I2(g)发生反应,反应开始时,碘蒸气的浓度是1mol·L-1,当达到平衡时c(HI)=0.9mol·L-1,求H2的转化率?(保留三位有效数字)
2HI(g)的平衡常数是50,在该温度下只充入H2与I2(g)发生反应,反应开始时,碘蒸气的浓度是1mol·L-1,当达到平衡时c(HI)=0.9mol·L-1,求H2的转化率?(保留三位有效数字)
东北师大附中2010-2011学年(上)
25.(4分)工业上用赤铁矿生产铁,可以选择的还原剂有C和H2,根据所学的知识判断:
已知:Fe2O3(s)+3/2C(s)=2Fe(s)+3/2CO2(g) ΔH=+233.8kJ·mol-1 ΔS=279J∙K-1∙mol-1
Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g) ΔH=+98kJ·mol-1 ΔS=144.2J∙K-1∙mol-1
问:那一种还原剂可使反应自发进行的温度低?(要求计算过程)(保留三位有效数字)
24.(9分)将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)
+ O2(g)  2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)= mol
(2)若起始时加入1.2molSO2 、0.6molO2 和xmolSO3 ,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是
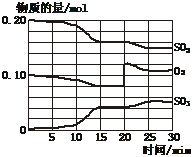 (4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
A. 加了催化剂 B. 缩小容器体积
C. 降低温度 D. 增加SO3的物质的量
23.(8分)在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:
2A(g)+B(g) 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度与W的关系(用“>”“<”“=”表示)。
(1)加入1 mol A和1 mol B时,C的平衡浓度_________W mol·L-1。
(2)加入2mol A、1mol B、3mol C、1mol D时,C的平衡浓度_________W mol·L-1。
(3)加入3 mol C和1 mol D时,C的平衡浓度_________W mol·L-1。
(4)加入2 mol B、3 mol C、1 mol D时,C的平衡浓度_________W mol·L-1。
22.(8分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
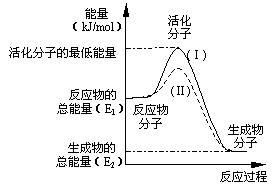 (1)图中所示反应是_____________(填“吸热”或“放热”)反应,该反应的△H=____________(用含E1、E2的代数式表示)。
(1)图中所示反应是_____________(填“吸热”或“放热”)反应,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1。该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是
。
21.(15分)下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属状态 |
C(H2SO4) /mol・L-1[ |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1. 1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明: 对反应速率有影响, 反应速率越快,
能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4) 实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: _________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com