
题目列表(包括答案和解析)
4. 在2A+B  3C+4D反应中,下面表示的反应速率最快的是( )
3C+4D反应中,下面表示的反应速率最快的是( )
A. VA=3.0mol·L-1·min-1 B. VB=0.2mol·L-1·s-1
C. VC=4.8mol·L-1·min-1 D. VD=4.0mol·L-1·min-1
3.下列反应的能量变化与其它三个不相同的是( )
A.铝粉与氧化铁的反应 B.氯化铵与消石灰的反应
C.锌片与稀硫酸反应 D.钠与冷水反应
2.
在2L的密闭容器中,发生以下反应:2A(g)+B(g) 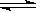 2C(g)+D(g),若最初加入的A和B都是4mol,在前10s 内A的平均反应速率为0.08mol/(L·s),则10s时容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4mol,在前10s 内A的平均反应速率为0.08mol/(L·s),则10s时容器中B的物质的量是( )
A. 3.6mol B. 3.2mol C. 2.4mol D. 1.2mol
1. 下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率
B.钢铁在干燥的空气里不易被腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.金属的电化学腐蚀比化学腐蚀更普遍
21. (14分) 300℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。
(1该反应的平衡常数表达式为:K= 。已知K300℃<K350℃, www.k@s@5@ 高#考#资#源#
则△H 0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为 ,D的平均反应速率为 。
(3)若温度不变,缩小容器容积,则A的转化率 (填“增大”减小”或 “不变”),
原因是 。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各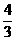 mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。


吉安一中2010-2011学年度上学期期中考试
20. (B类 ).(12分)现有①0.2 mol/L NaOH溶液 ②0.2 mol/LHX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-) ②中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)上述混合液中共存在 种粒子,且c(HX) c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-) 0.1 mol/L(忽略体积变化)。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为 。
19. (10分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250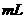 0.2
0.2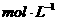 的醋酸溶液,用0.2
的醋酸溶液,用0.2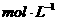 的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250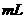 0.2
0.2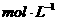 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
。
(2)为标定某醋酸溶液的准确浓度,用0.2000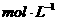 的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为
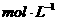 。(保留小数点后四位)
。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
|
醋酸浓度 (mol·L–1) |
0.00l0 |
0.0100 |
0.0200 |
0.1000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度 。(填“增大”、“减小”或“不变”)
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案
。
20(A类).(12分)常温下,浓度均为0.1 mol·L-1的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),
溶液中溶质存在电离平衡的是 ;
 (2)比较①、②溶液,PH值较大的是
;
(2)比较①、②溶液,PH值较大的是
;
(3)在溶液④中加入少量NH4Cl固体,此时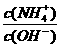 的值
的值
将 (填“变小”,“变大”或“不变”);
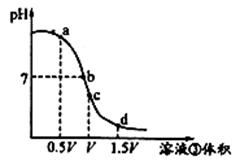
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点;
②取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,其它离子浓度由大到小的顺序是 。
18.(10分)已知KMnO4和H2C2O4在酸性溶液中发生反应:
KMnO4+ H2C2O4+ H2SO4 - K2SO4+ MnSO4+ CO2↑+ H2O(请配平)。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。
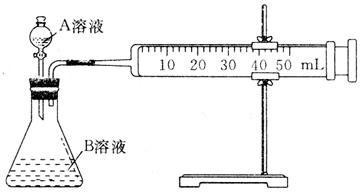
实验时A溶液一次性放下,A,B的成分见下表:
|
序号 |
A溶液 |
B溶液 |
|
① |
2mL 0.1 mol·L-1 H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液 |
|
② |
2mL 0.2 mol·L-1 H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液 |
|
③ |
2mL 0.2 mol·L-1L H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2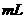 0.1
0.1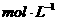 H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4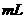 0.1
0.1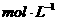 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究
对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是
。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究
对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是
。
16.(B类 )在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是 ( )
A. HNO2 B. HCOOH C. HCN D. H2CO3
第Ⅱ卷(非选择题,共52分)
17 (6分)(1)冰融化为水的过程的焓变和熵变正确的是
A △H>0,△S<0 B △H>0,△S>0
C △H<0,△S>0 D △H<0,△S<0 www.k@s@5@ 高#考#资#源#
(2)已知100KPa298K时石灰石分解反应为CaCO3(s)=CaO(s)+CO2(g)
△H=178.3kJ·mol-1,△S=160.4 J·mol-1·K-1,则该反应自发进行的最低温度为
16.(A类).已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1
= 4.3×l0_7 K2
= 5.6×l0_11 |
现维持25℃,下列有关说法正确的是 ( )
A.NaHCO3溶液中:c(OH-)-c(H+) = c(H2CO3)-c(CO32-)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中
c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com