
题目列表(包括答案和解析)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
|
|
|
|
|
|
|
|
|
|
|
|
33. 计算下列溶液的PH值:(lg2=0.3,lg5=0.7)
⑴若PH为2和PH为6两盐酸等体积混合,则混合后PH= ;
⑵若PH为9和PH为13两NaOH溶液等体积混合,则混合后PH= ;
⑶若PH为13的强碱溶液和PH为2的强酸溶液以1∶9体积比混合,则混合后PH= ;
三明一中2010-2011学年度上学期学段考试试卷
|
座号 |
|
高二化学答题卷 (理科)
32.1200℃时测得反应H2(g)+CO2(g)
 H2O(g)+CO(g)的平衡常数K为1。若反应从H2(g)和CO2(g)开始,且H2(g) 和CO2(g)的初始浓度均为0.0100 mol·L-1时,计算H2的平衡转化率。
H2O(g)+CO(g)的平衡常数K为1。若反应从H2(g)和CO2(g)开始,且H2(g) 和CO2(g)的初始浓度均为0.0100 mol·L-1时,计算H2的平衡转化率。
31. (7分)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表
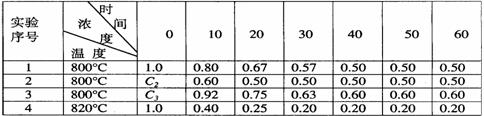
据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L· min)。
(2)在实验2,A的初始浓度c2= mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填“>”“=”“<”),且c3 1.0mol·L-1(填“>”“=”“<”)。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”“放热”)。理由是 。
30.(8分) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+
2N2(g) 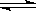 Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
 (3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= 。
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= 。
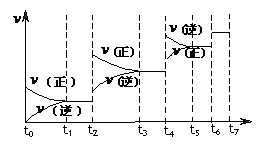
(4)达到平衡后,改变某一外界条件(不改变N2、CO
的量),反应速率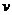 与时间t的关系如右图。图中t4时引起平衡
与时间t的关系如右图。图中t4时引起平衡
移动的条件可能是 ;图中表示平衡混合物中CO
的含量最高的一段时间是 。
29. (4分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2
(4分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;“正”、“逆”、“不”;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;“正”、“逆”、“不”;增大、减小、不变)。
⑴起始时两容器中的反应速率:v(A) v (B),反应过程中的反应速率:v(A) v(B)。
⑵达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向 反应方向移动,B中的化学反应速率 。(增大或减小或不变)
28. (9分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和PCl5 (g)。反应过程和能量关系如图所示(图中的ΔH表示生成l mol产物的数据)。
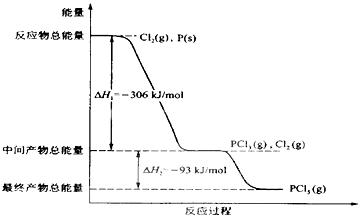
根据上图回答下列问题:
(1)PCl5分解成PCl3 和Cl2的热化学方程式是
。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5原因是 。
(3)P和Cl2分两步反应生成1mol PCl5的ΔH3 =__________,P和Cl2一步反应生成1 mol PCl5的ΔH4___________ΔH3(填“大于”、“小于”或“等于”)。简述原因:
27. (5分) (1)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
(1)在溶液中加入少量的KSCN固体,平衡 移动。
(2)在溶液中加入少量的FeCl3固体,平衡 移动,
(3)在溶液中加入少量的NaOH固体,平衡 移动,理由是: 。
26.(6分)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易
形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其负极是 ,负极反应式为 ;正极是 ,正极反应式 。
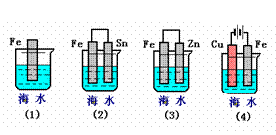
25.(3分)下列各情况,在其中Fe片腐蚀由快到慢的顺序是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com