
题目列表(包括答案和解析)
26、二氧化氯(ClO2)作为一种高效强氧化剂,常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。
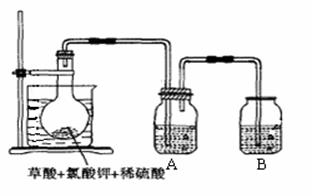
(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为______________________________,氧化产物与还原产物的物质的量之比为____________。
(2)控制水浴温度在60-80℃之间的目是_______________,图示装置中缺少的一种必须的玻璃仪器是_____________。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放_______。(填序号)
①60 ℃的温水 ②冰水 ③饱和食盐水
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量用稀硝酸酸化过的氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式____________________________________
25、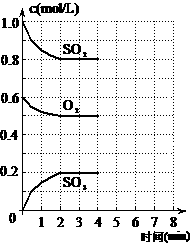 在t℃下发生如下反应:
在t℃下发生如下反应:
2SO2(g)+O2(g)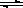 2SO3(g)+Q(Q>0),右图是反应过程中,体系内各物质浓度的变化情况。
2SO3(g)+Q(Q>0),右图是反应过程中,体系内各物质浓度的变化情况。
(1)根据图中数据可知,在t℃下此反应的化学平衡常数K的值为 ;在2分钟内,SO2的平均反应速率为 。
(2)若降低温度,该反应的K值 ,SO2转化率 ,化学反应速度 (均填”增大”、”减小”、”不变”)
(3)在t℃下,某时刻测得反应混合物中:[SO2]=[SO3],且[O2]=0.45mol/L,则此刻反应是否处在平衡状态? (“是”或”否”)。此时v(正) ______v(逆)(填>,<,=)。
(4)在4分钟时将氧气浓度减少0.1mol/L,并在6分钟时重新达到平衡,此时SO2的浓度改变了0.1mol/L,请在图上画出3种物质浓度的变化曲线。
24、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可以析出高铁酸钾。制备方法有:①湿法:次氯酸盐氧化法;②干法:高温过氧化物法。
(1)湿法制备的主要反应方程为:
____Fe(OH)3+___NaClO+___ _______→___Na2FeO4+___NaCl+___H2O
在空格中填写适当物质,并配平反应方程式,且标出电子转移的方向和数目。
(2)干法制备中牵涉到的物质有:FeSO4、Na2FeO4、Na2SO4、Na2O2
发生氧化反应的过程是:_________→___________
(3)制备相同质量Na2FeO4时转移的电子数,湿法制备____干法制备(填“>”或“<”或“=”)。
(4)高铁酸钾和二氧化氯都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是不相同的,则高铁酸钾的效率是二氧化氯的______倍。
23、四种前18号元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质结构信息 |
室温下单质呈粉末状固体,加热易熔化。单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是黄绿色气体,能溶于水。 |
单质质软、银白色固体、导电性强。它是生理盐水中一个重要的元素。 |
原子最外层电子数是K层电子的两倍。单质为空间网状晶体,具有很高的熔、沸点。 |
(1)B元素的离子结构示意图为______________,它和C形成的化合物的电子式为_____________。
(2)B单质和A、C两元素形成的化合物反应的离子方程式________。
(3)D元素最高价氧化物晶体的硬度_______(填“大”或“小”),其理由是___________________。
22、a molFeS与b molFeO投入到V L、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A、(a+b)×63g B、(a+b)×189g C、(a+b)mol D、(Vc-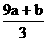 )mol
)mol
21、在固定容积的密闭容器中,可逆反应2X+Y(g) 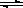 Z(s)
已达到平衡,此时升高温度则气体的密度增大,下列叙述正确的是
Z(s)
已达到平衡,此时升高温度则气体的密度增大,下列叙述正确的是
A、若加入少量的Z,该平衡向左移动
B、正反应为放热反应,X可能是气态、液态或固态
C、若X为非气态,则正反应为吸热反应
D、正反应为放热反应,X一定为气态
20、下列有关说法不符合事实的是
A、同温同压下,气体的体积取决于气体的物质的量的大小
B、氧化剂的氧化性强弱取决于该氧化剂中某元素化合价的高低
C、物质溶解是否达到溶解平衡状态取决于溶质与溶剂的相对多少
D、电解质的强弱取决于电解质在水溶液中电离程度的大小
19、下列离子方程式正确的是
A、氢氧化钡溶液中滴加硫酸氢钠:
Ba2++SO42-+H++OH-→BaSO4↓+H2O
B、实验室用启普发生器制二氧化碳:
CO32-+2H+→CO2↑+H2O
C、碳酸氢铵溶液中加入过量的氢氧化钠溶液:
HCO3-+OH-→CO32-+H2O
D、5.6gFe与200mL2.0mol/LHNO3溶液充分反应:
3Fe+2NO3-+8H+→3Fe2++2NO↑+4H2O
18、氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
aHClO3→bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A、由反应可确定:氧化性HClO4>HClO3
B、变蓝的淀粉碘化钾试纸褪色是因为可能发生了下列反应:
5Cl2+I2+6H2O→12H++10Cl-+2IO3-
C、若氯酸分解所得的1mol混合气体质量为47.6g,则反应方程式可表示为:
26HClO3→15 O2↑+8Cl2↑+10HClO4+8H2O
D、若化学计量数a=8,b=3,则电子转移的数目为20e
17、在一密闭容器中,用一不漏气的滑动活塞隔开,常温时左边充入3/4体积H2和O2混合气体,在右边充入1/4体积N2。若将左边混合气体点燃充分反应后恢复到原温,活塞停留在中间,则反应前混合气体中H2和O2的体积比可能是
A、2:1 B、1:2 C、5:4 D、7:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com