
题目列表(包括答案和解析)
项符合题意。若正确答案只有一个选项,多选时则为0分;若正确答案包括两个选项,只
选一个且正确的得2分,选两个且都正确的得满分,若选错一个,该小题就为0分)
8.25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g); △H=+56.76kJ/mol,自发进行的原因是:
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
7.为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
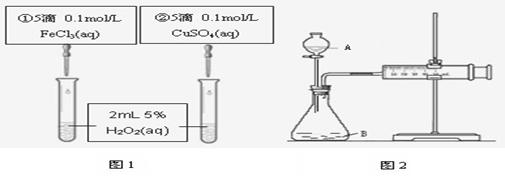 D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
6.在相同条件下(T=500K),有相同体积的甲、乙两密闭容器。甲容器中充入1 g SO2和1 g O2;乙容器中充入2 g SO2和2 g O2。下列叙述错误的是
A.化学反应速率:乙>甲
B.平衡后SO3的浓度:乙>甲
C.SO2的转化率:乙>甲
D.平衡后SO2的体积分数:乙>甲
5.把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
A、10℃20 mL 3 mol/L的X溶液 B、10℃10 mL 2 mol/L的X溶液
C、20℃10 mL 4 mol/L的X溶液 D、20℃30 mL 2 mol/L的X溶液
4.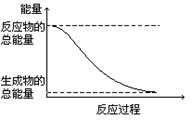 下列变化为放热反应的是
下列变化为放热反应的是
A、能量变化如右图所示的化学反应
B、2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C、形成化学键时共放出能量862 kJ的化学反应
D、H2O(g)=H2O(l) △H=-44.0 kJ/mol
3.下列说法或表示方法中正确的是
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、需要加热才能发生的反应一定是吸热反应
C、在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7KJ/mol
2.为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A、乙醇汽油是一种清洁能源,燃烧不会产生污染
B、乙醇与汽油组成元素相同,化学成分相似
C、乙醇汽油燃烧时,耗氧量高于等质量的汽油
D、乙醇可通过淀粉转化制得,是一种可再生的燃料
1.人类将在二十一世纪大量使用氢气作燃料,其中最理想的获取氢气的途径是
A.以焦炭和水制取水煤气后分离出氢气
B.用铁、锌等活泼金属与稀硫酸制取氢气
C.由火力发电厂提供电力电解水产生氢气
D.利用高效催化剂和太阳能使海水分解产生氢气
35.(14分)已知Co(H2O)62+显粉红色,CoCl42-显蓝色。CoCl2晶体在不同的盐酸溶液中会显示不同的颜色:①在很稀的盐酸中呈粉红色,②在浓盐酸中呈蓝色,③在一定浓度的盐酸中会呈紫色。
(1)某同学将一定量的氯化钴晶体溶于浓盐酸中,然后在该溶液中加入大量水,溶液的颜色如何变化? ,其原因为 。(请用相关的离子方程式和适当的文字进行说明)。写出对应平衡的平衡常数表达式K= 。[
(2)某同学将盛有③获得的溶液的试管置于热水中,溶液变为蓝色,则说明该平衡的ΔH
0(填“<”、“>”或“=”),此时,平衡常数K (填“变大”、“变小”或“不变”)。
(3)已知Fe(OH)3的Ksp=1.0×10-38,Co(OH)2的Ksp=1.6×10-15。若0.1mol·L-1的CoCl2溶液中含有Fe3+,调节pH使Fe3+沉淀完全[即c(Fe3+)<10-5 mol·L-1]时的pH=
,此时Co2+是否开始沉淀? (填“是”或“否”)。
34.(8分)
(1)在一定的温度下,在一个密闭容器中充入x mol的SO2和y mol和O2发生反应,达到平衡状态时,SO2的转化率为a%,O2的转化率为b%。如果a=b则x:y ,a>b则
x: y 。
(2)如果在一个容积可变密闭容器中,达到平衡状态时SO2和O2和SO3物质的量浓度的比是2:0.8:2,此时向容器里将SO2、O2和SO3各充入1mol,保持压强不变,再达到平衡时,SO2的转化率 。(填增大、减少、不变)
(3)一定温度下,在体积不变的密闭容器中,充入平均相对分子质量为48的SO2和O2的组成的混合气体,达到平衡时,混合气体的平均相对分子质量为60,则SO2的转化率是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com