
题目列表(包括答案和解析)
4.反应A+B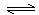 C在温度T1下进行,反应D+E
C在温度T1下进行,反应D+E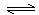 F在温度T2下进行,已知T2﹤T1,且D和E的浓度均小于A和B的浓度(其它条件均相同)则两者的反应速率( )
F在温度T2下进行,已知T2﹤T1,且D和E的浓度均小于A和B的浓度(其它条件均相同)则两者的反应速率( )
A.前者大 B.后者大 C.一样大 D.无法确定
3.某物质的水溶液能导电,且该物质属于非电解质,溶于水时化学键被破坏的是 ( )
A.干冰 B.液溴 C.蔗糖 D.碳酸钡
2.绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中的电能、氢能等。下列能源属于绿色能源的是( )
①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材 ⑦核能
A.①②③⑦ B.③④⑤⑦ C.①②⑤ D.④⑤⑥
1.反应2A(g)+B(g) 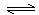 2C(g) ΔH>0 下列的反应条件有利于生成C的是 ( )
2C(g) ΔH>0 下列的反应条件有利于生成C的是 ( )
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
21.(10分)如图所示,当关闭K时,向A中充入2molX、7molY,向B中充入4molX、14molY,起始时VA=VB=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
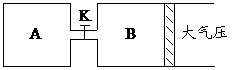 (1)B中X 的转化率α(X)B为__________。
(1)B中X 的转化率α(X)B为__________。
(2)A中W和B中Z的物质的量的比较:
n(W)A ______ n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_______升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是_________________。
2010-2011学年度第一学期金山中学高二期中考试
20.(10分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。已排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________
________________________________________________________________________________。
(3)同学们在探究0.01mol/L KMnO4溶液与0.2mol/L H2C2O4溶液发生反应2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O时发现,反应前阶段KMnO4溶液褪色速率非常缓慢,但后阶段的褪色速率却非常快,同学们分析后阶段褪色速率却非常快是因为某物质对上述反应起了______作用,该物质可能是_________。
(4)受上述探究实验的启发,同学们顺利提出了“铝与稀盐酸和稀硫酸反应差异的原因”。你能对该问题原因做出某些假设或猜想吗?(列出两种即可,Al3+的影响已经排除)
假设一:________________________________________________________________________;
假设二:________________________________________________________________________;
如何设计实验验证你的假设,请简述你设计的实验的要点:
_______________________________________________________________________________。
19.(10分)向2L密闭容器中通入amol 气体 A和bmol气体B,在一定条件下发生反应;
xA(g) + yB(g) pc(g)
+ qD(g)
pc(g)
+ qD(g)
已知:平均反应速率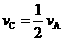 ;反应2min 时,A的浓度减少了
;反应2min 时,A的浓度减少了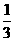 ,B的物质的量减少了
,B的物质的量减少了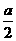 mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2min内,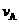 =
,
=
,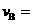 ;
;
(2)化学方程式中,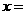 、
、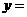 、
、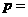 、
、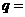 ;
;
(3)反应平衡时,D为2a mol,则B的转化率为 ;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的
0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”),理由是 ;
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由是 ;
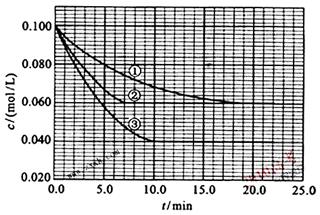
18.(10分) 在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②改变的条件__________;判断理由__________________________________________。
③改变的条件__________;判断理由__________________________________________。
(2)实验②平衡时B的转化率为_______;实验③平衡时C的浓度为___________;
(3)该反应的△H______0,其判断理由是___________________________________________
(4)该反应进行到4.0min时的平均反应速率:(要求列出运算过程并计算出结果)
实验②: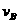 =_____________________________________________________________
=_____________________________________________________________
实验③: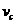 =______________________________________________________________
=______________________________________________________________
17.(12分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:_____________________________________。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)
+ CO(g) CH3OH(g);ΔH=-90.8 kJ·mol-1
CH3OH(g);ΔH=-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) +
H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) +
H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g)
+ 3CO(g) CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
16.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了 B.物质A的转化率减小了
C.物质B的体积分数增加了 D.a>b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com