
题目列表(包括答案和解析)
1、氮气的化学性质比较稳定的原因是( )
A、分子中两个氮原子间以其共价结合 B、分子中两个氮原子间键能很大
C、分子是直线型的 D、 氮原子失电子比较难
22.(13分)A和B在一定条件下可合成芳香族化合物E,G在标准状况下是气体,此情况下的密度为1.25g/L。各物质间相互转化关系如下所示:
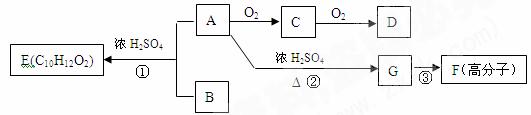
请回答下列问题:
(1)①G中的官能团是 (用化学式表示)。
② D中的官能团名称是 。
③F的结构简式为 。
(2)指出反应类型:① ,② ,③ 。
(3) ①写出化学方程式:A→C ;
②C与新制的氢氧化铜悬浊液反应: 。
(4)满足下列条件的B的同分异构体有 种。
①遇FeCl3溶液显紫色 ②能发生银镜反应 ③苯环上只有两个取代基
21.(13分)按要求填空。
(1)经测定某含氧有机物的相对分子质量为94。现取9.4g该含氧有机物充分燃烧后的产物通过浓硫酸后增重5.4g,并收集到标准状况下CO2气体13.44L。则
①该含氧有机物的分子式为 ;
②请写出该含氧有机物中官能团的名称 。
(2)完成下列变化的化学方程式:
①苯与浓硫酸、浓硝酸的混合酸在50-60℃时的反应 。
②苯酚与浓溴水反应
③二氧化碳通入苯酚钠溶液,产生白色浑浊 。
④家用液化气的主要成分之一是丁烷,当1g丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为50kJ。丁烷燃烧的热化学方程式为 。
20.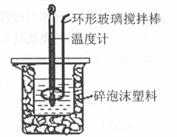 (10分)用50 mL 0.50mol·L-1盐酸与50 mL
0.55 mol·L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热。
(10分)用50 mL 0.50mol·L-1盐酸与50 mL
0.55 mol·L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度t2/℃ |
温度差 (t2-t1)/℃ |
||
 |
 |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.2 |
24.45 |
27.6 |
3.15 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪器是 ;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是 ;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指 温度;
(4)计算该实验发生中和反应时放出的热量为 kJ(保留两位小数)[中和后生成的溶液的比热容c=4.18 J·(g·℃)-1,稀溶液的密度都为1 g·cm-3];
(5)如果用50 mL 0.55 mol·L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其放出的能量将偏小,其原因是 。
19.(3分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H=
18.(5分)从下列选项中选择适当的字母填空。
A.渗析 B.凝聚 C.盐析 D.布郎运动 E.电泳 F.丁达尔现象
(1)Fe(OH)3胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫 。
(2)一束光线通过Fe(OH)3胶体,可看到光亮的通道,这种现象叫 。
(3)将淀粉和食盐的混合溶液放在半透膜制成的口袋中,并把它悬挂在盛有蒸馏水的烧杯里,从而使淀粉与NaC1分离,这种方法叫 。K^S*5U.C#O%
(4)Fe(OH)3胶体加入硅酸胶体后变浑浊,这是发生了
(5)向油脂皂化反应后所得的溶液中加入细粒食盐使肥皂析出,这种操作是 。
17、(8分) 按要求填空:
(1)甲基的电子式是
(2)在戊烷的各种同分异构体中,一氯代物只有一种的结构简式是
(3)用系统命名法命名该物质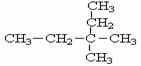
(4)写出2,4,6-三硝基甲苯的结构简式
16.根据表中烃的含氧衍生物分子式排列规律,空格中烃的含氧衍生物的有关判断正确的是
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
CH2O2 |
C2H4O |
C3H6O2 |
C4H8O |
|
C6H12O |
C7H14O2 |
C8H16O |
A.能与NaHCO3反应的同分异构体有3种 B.该物质肯定能发生加成反应和取代反应
C.1mol符合该分子式的一种有机物与足量Na反应能生成1mol H2,则该物质中一定存在一条碳碳双键
D.该物质与丁烷以任意物质的量比混合时,只要混合物的物质的量一定,消耗的氧气量也一定
第Ⅱ卷(共6题,52分)
15.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A、28g乙烯所含共用电子对数目为6NA
B、1 mol甲基(-CH3)所含的电子总数为9NA
C、0.5 mol 1, 3-丁二烯分子中含有C=C双键数为 NA
D、标准状况下,11.2 L己烷所含分子数为0.5 NA
14.某有机物的结构简式为 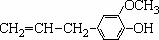 ,该物质不应有的化学性质是:( )
,该物质不应有的化学性质是:( )
①可以燃烧 ②可与Br2反应 ③可被KMnO4氧化
④可与NaHCO3溶液反应 ⑤可与NaOH溶液反应 ⑥可以发生消去反应。
A.①③ B.③⑥ C.④⑥ D.④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com