
题目列表(包括答案和解析)
3. 在可逆反应中,改变下列条件一定能加快反应速率的是( )
A.增大反应物的量 B.升高温度 C.增大压强 D.使用催化剂
2.下列反应中生成物总能量高于反应物总能量的是( )
A 碳酸钙受热分解 B 乙醇燃烧
C 铝粉与氧化铁粉末的反应 D 氧化钙溶于水
1.下列对化学反应的认识错误的是( )
A 一定有化学键的变化 B 一定会产生新的物质
C 一定有物质状态的变化 D 一定伴随着能量的变化
21.下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。
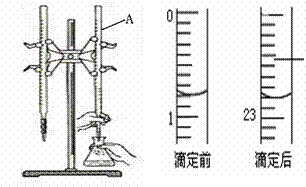
请回答:
⑴ 仪器A的名称是 ;
⑵ 盐酸的体积读数:滴定前读数为 mL,滴定后读数为 mL 。
⑶ 某实验小组同学的三次实验的实验数据如下表所
示。 根据表中数据计算出的待测NaOH溶液的平均
浓度是 mol/L。(保留四位有效数字)
|
实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
|
1 |
20.00 |
1.20 |
23.22 |
|
2 |
20.00 |
1.21 |
29.21 |
|
3 |
20.00 |
1.50 |
23.48 |
⑷ 滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用待测NaOH溶液润洗碱式滴定管2~3次后用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)________
⑸ 判断到达滴定终点的实验现象是_____________ 。
⑹ 对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失。_________
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是 ;
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是 ;
④取待测液时,滴定前仰视,滴定后俯视,对测定结果的影响是 。
2010--2011学年度(上)庆安三中
20.(1)17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 mol·L-1、c(N2O4)=0.012 mol·L-1。则反应2NO2(g)  N2O4(g)的平衡常数K=_________。
N2O4(g)的平衡常数K=_________。
(2)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu为_________克。
19.已知1g氢气完全燃烧生成水蒸气放热120.9kJ,写出该反应的热化学方程式_______________________
若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的△H=______________ kJ· 。
。
18.现有下列物质 ①KCl固体 ②液态SO2 ③冰醋酸 ④硫酸钡
⑤铜 ⑥酒精 ⑦熔融的NaCl ⑧NaOH溶液 请用以上物质回答下列问题。(填序号) (1)属于强电解质且在上述状态下能导电的是 ; (2)属于弱电解质的是 ; (3)属于非电解质,但溶于水后的水溶液能导电的是 ;
17. 常温下,pH=13的强碱溶液与pH=2的强酸溶液混合(混合溶液的体积变化忽略不计),所得溶液的pH=11,则强碱与强酸的体积比是 ( ).
A.11∶1 B.9∶1 C.1∶9 D.1∶11
16. “摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 ( )
A.氯化钠 B.固体硝酸钾 C.生石灰 D.苛性钠
15.一定量的Fe与过量的稀硫酸反应制取氢气,一定温度下为加快反应速率而又不影响氢气的量,可向其中加入( )
A.NaCl固体 B.SO3固体 C.Zn粉 D.CuSO4·5H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com