
题目列表(包括答案和解析)
17.(14分)
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:
N2(g) + 2O2(g)= 2NO2(g) △H = +67.7 kJ/mol;N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________ 。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”), H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
① 当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)
② 在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
16.下列各离子浓度的大小比较,正确的是
A.同浓度下列溶液中:① (NH4)2SO4 ② NH4HCO3 ③ NH4Cl ④ NH3·H2O,
c(NH4+)由大到小的顺序是:① > ③ > ② > ④
B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-)
C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) = c (HCO3-) + c (H+) + c (H2CO3)
D.0.01 mol·L-1 的NH4Cl溶液与0.05mol·L-1 的NaOH溶液等体积混合:
c (Cl-)> c (NH4+)> c (Na+)>c (OH-)>c (H+)
15.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是
A.2A ( l ) + B ( l ) = 2C (g ) △H1 B.2A ( g ) + B ( g ) = 2C (g ) △H2
C.2A ( g ) + B ( g ) = 2C ( l ) △H3 D.2A ( l ) + B ( l ) = 2C ( l ) △H4
13.表示0.1mol/LNaHCO3溶液中有关微粒的关系式,正确的是( )
a+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) B. C(Na+) +c( H+) =c(HCO3-)+ c(CO32-) +c(OH-)
C. C(Na+) +c( H+) =c(HCO3-)+c (CO32-) +2c(OH-) D. C(Na+) =c(HCO3-) +c (CO32-) +c(H2CO3)

12.将pH=11 NaOH溶液和pH=3的醋酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是 ( )
A.c(CH3COO-)< c(Na+) B.c(CH3COO-)> c(Na+)
C.c(H+)< c(OH-) D.c(OH-)> c(CH3COO-)
11.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
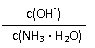
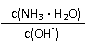
A. B.
C. c(H+)和c(OH-)的乘积 D.OH-的物质的量
10.对可逆反应2A(s)+3B(g) C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v(正)减小 ③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
9.在一定条件下,对于密闭容器中进行的反应P(g)+Q(g) R(g)+S(g)下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
R(g)+S(g)下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
A.P、Q、R、S的浓度相等
B.P、Q、R、S在密闭容器中共存
C.P、Q、R、S的浓度不再变化
D.用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等
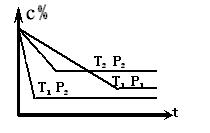
8.已知某可逆反应:mA(g)+nB(g) xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%) 的关系曲线,则正确的是(
)
xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%) 的关系曲线,则正确的是(
)
A.T1>T2 ,P1>P2 ,m+n>x ,正反应放热
B.T1<T2 ,P1<P2 ,m+n<x ,正反应吸热
C.T1>T2 ,P1<P2 ,m+n<x ,正反应放热
D.T1<T2 ,P1>P2 ,m+n>x ,正反应吸热
7.如果一个反应△H-T△S值为零,则此反应( )。
 A. 能自发进行 B. 是放热反应 C. 不进行 D. 处于平衡状态
A. 能自发进行 B. 是放热反应 C. 不进行 D. 处于平衡状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com