
题目列表(包括答案和解析)
6.下列做法正确的是
A.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
B.为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂
C.食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿大
D.为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果
5.氯气有毒,曾被法西斯制成毒气弹用于侵略战争。当发生氯气泄漏时,通常可用的防御方法是
A.人、畜应躲到低洼的地方 B.人、畜应向顺风的地方去
C.人、畜应多饮豆浆和牛乳 D.可用肥皂水或尿浸湿软布蒙面
4.为了保护臭氧层,可采取的有效措施是
A.减少二氧化硫的排放 B.减少含铅废气的排放
C.减少氟氯代烃的排放 D.减少二氧化碳的排放
3.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为
A.元素 B.单质 C.分子 D.氧化物
2.室内空气污染的主要来源之一是泡沫绝缘塑料、化纤地毯、书报、油漆等不同程度释放出的气体,该气体是
A.甲烷 B.甲醛 C.一氧化碳 D.二氧化碳
1.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及的是
A.SO2 B.NO2 C.CO2 D.可吸入颗粒物
24.(10分)A-G是中学化学常见的七种物质,均由短周期元素组成,常温、常压下 C为无色液体,D、E为气体单质,B为金属单质。A-G可发生如下转化:
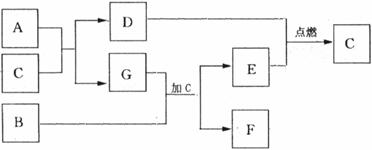
请填写下列空白:
(1)C中含有的化学键类型__________,G的电子式__________。
(2) 5.4gB与G完全反应,转移的电子数目是__________。
(3)向F的水溶液中通入足量的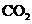 气体,发生反应的离子方程式是:
气体,发生反应的离子方程式是:
________________________________________________________________________
(4)8gD单质完全燃烧生成气态C,放出967.2kJ热量,该反应的热化学方程式是:
________________________________________________________________________
2010-2011学年第一学期期中考试高二
23.(14分)化工生产中常常用到“三酸”“两碱”,其中,“三酸”是指盐酸、硫酸和硝酸,“两碱”是指烧碱和纯碱。
(1)从物质分类学的角度看,分类不恰当的一种物质是_________。
(2)“三酸”与“两碱”之间均可发生反应,可以写出很多化学方程式,而反应的离子方程式数目要少得多,请写出下列离子方程式。
①烧碱与“三酸”反应______________________。
 ②将少量的“三酸”与滴入纯碱溶液中
______________________;
②将少量的“三酸”与滴入纯碱溶液中
______________________;
(3)“三酸”常用于溶解金属或金属氧化物,写出下列反应的化学方程式。
①金属铁与稀硫酸反应______________________________。
②金属铜与浓硫酸共热_____________________________。
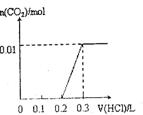
(4)由“两碱”组成的混合物若干,将它溶于水配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。加入盐酸的体积和生成CO2的物质的量的关系如右图表示。
则原混合物中含NaOH_____g,Na2CO3 ______g。
22.(20分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有
___________________________、_______________________________
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________________________
______________________
(3)要加快上述实验中气体产生的速率,还可采取的措施有______________________
_________________________________________(任意答一种)。
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。记录获得相同体积的气体所需时间。
 实验
实验混合溶液 |
A |
B |
C |
D |
E |
F |
|
4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=______,V6=______,V9=______。
②反应一段时间后,A中金属表面是呈_______色,E中的金属表面呈_______色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高;但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。
请分析当加入的CuSO4溶液超过一定量时,氢气生成速率下降的主要原因是______
_________________________________________。
21.(10分)某化学兴趣小组的学习卤素以后,做了下列实验:
向滴有淀粉的KI溶液中滴加氯水,溶液出现蓝色;继续滴加氯水,溶液蓝色逐渐变浅最后变为无色。
(1)滴加氯水时溶液出现蓝色的离子方程式是____________________________。
(2)对于继续滴加氯水,溶液蓝色逐渐变浅最后变为无色的原因,请完成以下实验探究过程。
Ⅰ、提出假设
假设1:I2被氧化。
假设2:淀粉和I2都被氧化。
假设3:__________。
Ⅱ、实验设计
|
实验步骤 |
预期现象与结论 |
|
|
|
|
|
|
Ⅲ、问题与讨论
实验表明I2被氧化是蓝色消失的原因,化学方程式是:_____+____+____== HIO3+_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com