
题目列表(包括答案和解析)
5. 从下列事实,找出不能用勒沙特列原理解释的是 ( )
A.在溴水中存在如下平衡: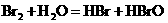 ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对

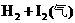 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应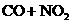

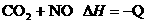 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应: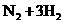

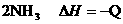 ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
4. 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是
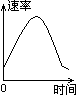 A. ①④ B. ③④ C. ①②③ D. ②③
A. ①④ B. ③④ C. ①②③ D. ②③
3.已知反应A+3B==2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L·min),则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5mol/(L·min) B.1 mol/(L·min)
C.2 mol/(L·min) D.3 mol/(L·min)
2.下列反应中生成物总能量高于反应物总能量的是
A 碳酸钙受热分解 B 乙醇燃烧
C 铝粉与氧化铁粉末反应 D 氧化钙溶于水
1.在25℃、101KPa下,1g甲醇燃烧生成CO2和液态水时放热22.68KJ,下列热化学方程正 确的是
A.CH3OH(l)+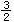 O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452KJ/mol
C.CH3OH(l)+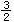 O2(g)=CO2(g)+2H2O(g) ΔH=-725.8KJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-725.8KJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1452KJ/mol
27、一定温度下,将3 mol A气体和1 mol B气体通人一密闭容器中,发生如下反应:
3A(g)+B(g) 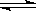 xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2 L,反应2min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①2min内,A的平均反应速率为_______________,x= ;
②已知平衡混合物中C的体积分数为25%,则B的转化率________;
③改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量分别为a、b、c,它们之间应该满足的关系式为
(2)若维持容器压强不变:
①达到平衡时C的体积分数__________25%(填“大于”、“等于”或“小于”);
②改变起始物质加人的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________mol A气体和__________mol B气体。(不要求写计算过程)
26、发射卫星时可用肼(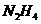 )为燃料,用
)为燃料,用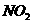 作氧化剂,这两种物质反应生成
作氧化剂,这两种物质反应生成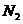 和水蒸气
和水蒸气
已知N2(g)+2O2(g)=2NO2(g);△H=+67.7KJ/mol
N2H4(g)+ O2(g) = N2(g)+2H2O(g);△H=-534.7KJ/mol
(1)计算1 肼和
肼和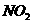 完全反应放出的热量为
KJ。
完全反应放出的热量为
KJ。
(2)写出肼和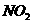 反应的热化学方程式
反应的热化学方程式
25、准确移取25.00 mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01mL |
18.20mL |
|
第二次 |
0.20mL |
18.41mL |
|
第三次 |
0.40mL |
18.60mL |
(1)判断滴定终点的现象是:
(2)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(3)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3)测出的盐酸浓度 (填“偏高”、“偏低”或“不变”)。
(4)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(5)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? (填 “是”或“否”)
24、醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。请回答:
(1) 写出醋酸钠在水中发生水解反应的离子方程式: ;
(2) 在CH3COONa溶液中离子浓度由大到小的顺序为
(3)对于醋酸溶液和醋酸钠溶液的下列说法正确的是 ;、、
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小;
B.升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解;
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离;
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸电离
(4) 已知:CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
23、可逆反应m A+n B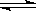 p
C在某温度下达到平衡。
p
C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 。
②若C为气体,且m + n = p,加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不移动,则B肯定不能为_____ 态。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com