
题目列表(包括答案和解析)
5. 常温时,将a1mL,b1mol/L 的CH3COOH溶液加入到a2mL,b2mol/L 的NaOH溶液中,下列结论中不正确的是( )
A.如果a1b1=a2b2,则混合溶液的pH>7
B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果a1=a2,b1=b2,则混合液液中c(CH3COO-)=c(Na+)
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
4. 某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A == H++HA-,
HA- H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是( )
H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是( )
A.c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B.c(OH-)=c(H+) +c( HA-)
C.c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D.c(Na+ )= 2c(A2-) +2c( HA-)
3. 现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四
种溶液:①盐酸 ②硫酸 ③醋酸 ④NaOH,下列说法正确
的是( )
A.pH由小到大的顺序是①<②<③<④
B.溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③
C.取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③
D.取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9
2. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法
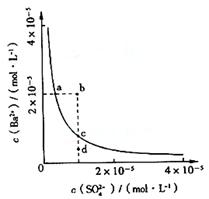 正确的是( )
正确的是( )
提示:BaSO4(s) 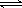 Ba2+(aq)+SO42-(aq)的平衡
Ba2+(aq)+SO42-(aq)的平衡
常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
1. MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所
示。下列叙述中正确的是( )
A.ROH是一种强碱
B.在x点,MOH完全电离
C.在x点,c(M+)>c(R+)
D.稀释前,c(ROH)==10c(MOH)
22.(6分)(1)一定温度下,某难溶电解质AB2饱和溶液中C(A+)=Xmol/L,C(B-)=Ymol/L,AB2的Ksp为 (用X、Y表示)。
(2)通过计算回答:
将等体积的4×10-3mol/L的AgN03溶液和4×10-3mol/L的K2CrO4溶液混合,是否析出Ag2CrO4沉淀?
(已知Ksp=9.0×10-12)
。
2010-2011学年第一学期十一县(市)高二年级期中联考
21.(4分)泡沫式灭火器内盛放Al2(SO4)3溶液(约1mol/L)、NaHCO3溶液(约1mol/L)及起泡剂。使用时发生的离子方程式是______________________,Al2(SO4)3溶液和NaHCO3溶液的体积比约是___________。泡沫灭火器玻璃筒里盛放Al2(SO4)3溶液,铁筒里存放NaHCO3溶液,不能把Al2(SO4)3溶液盛放在铁筒里的原因是(用离子方程式表示)__________________ ____
20.(13分)25℃时,将0.01 mol CH3COONa 和0.002 molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示:
① ②
③
(2)溶液中共有______种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol/L的是________,浓度为0.002 mol/L的是________。
(4)在上述溶液中,存在的两个守恒关系是:物料守恒 ,电荷守恒___________________________________。
19.(9分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用 作指示剂。
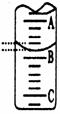
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间
相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;
反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每
次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次
实验结果记录如下:

从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L
18.(6分)在一个1 L的密闭容器中,加入2 mol A和1 mol B,发生下列反应:
2A(g) + B(g)  3C(g) + D(s), 达到平衡时,C的浓度为1.2
mol·L-1。
3C(g) + D(s), 达到平衡时,C的浓度为1.2
mol·L-1。
(1)维持容器的温度不变,若缩小容器的体积,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(2)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol·L-1的是 。
A.4 mol A+2 mol B B.3 mol C+1 mol D C.2 mol A+1 mol B+1 molD
 (3)若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2 mol·L-1,则C的起始物质的量应满足的条件是
。
(3)若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2 mol·L-1,则C的起始物质的量应满足的条件是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com