
题目列表(包括答案和解析)
4.下列试剂属于纯净物的是( )
A.盐酸 B.合金 C.氯水 D.蒸馏水
3.下列物质属于电解质的是( )
A.Cu B. CH3CH2OH C.NaCl D. Cl2
2.“环境保护,以人为本”,从2000年6月起,新调整的上海空气质量指标中指出,影响上
海空气质量的一组主要污染物是( )
A.SO2、NO2、可吸入颗粒物 B.CO2、N2、O2
C.CO2、O2、SO2 D.NO2、N2、可吸入颗粒物
1.目前,“酒后驾车”成为公安部在全国范围内重点严惩的行为,交警执法时,主要测量驾
驶员体内的( )
A.醋酸 B.酒精 C.蛋白质 D.葡萄糖
21.(8分)在一定条件下,在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
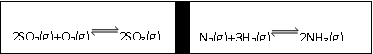
(1)若起始时两边分别投入2 mol SO2、1 mol O2;1 mol N2、3 mol H2,达到平衡后,隔板能否处于中央 (填“是”或“否”)。
(2)若起始时投入2 mol SO2、1 mol O2;1 mol N2、2 mol H2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字);
(3)若起始时投入2 mol SO2、1 mol O2;1 mol N2、a mol H2、0.1 mol NH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围
20.(12分)在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(气)+H2O(气) CO2(气)+H2(气)(正反应是放热反应)
CO2(气)+H2(气)(正反应是放热反应)
(1)改变条件,能使正反应速率增大的是 (填序号)
A.降温 B.加压 C.减小CO2的浓度 D.使用催化剂
(2)CO和H2O浓度变化如下图,则0-4min的平均反应速率v (CO)= mol/(L·min)
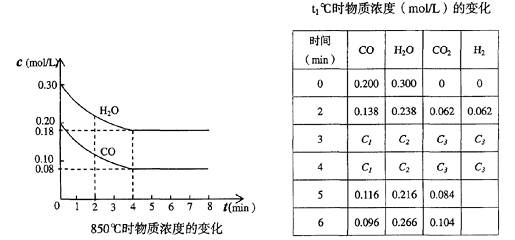
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态;C1数值_________0.08 mol/L (填“大于”、“小于”或“等于”)。
②反应在4min-5min间,平衡向逆方向移动,可能的原因是______,表中5min-6min之间数值发生变化,可能的原因是__________。
A、增加水蒸气 b、降低温度 c、使用催化剂 d、增加氢气浓度
19.(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,
C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。D、A可按原子个数比3:2形成离子化合物丙。E是地壳中含量最高的金属元素。
根据以上信息回答下列问题:
(1)B元素在周期表中的位置是第 周期,第 族,丙的化学式是 。
(2)由上述元素中的三种组成的水溶液呈碱性的盐的化学式为 ,
其水溶液呈碱性的原因是 (用离子方程式表示)。
18. (12分)已知硫酸在水中的电离方程式是H2SO4==H++HSO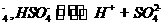 ,
,
回答下列问题:(1)Na2SO4溶液显________(填“酸性”、“中性”或“碱性”)。理由是____________________________________________________________(用离子方程式表示)。
(2)在0.1mol·L-1的Na2SO4溶液中,下列微粒浓度关系正确的是( )
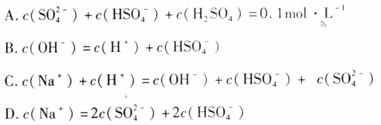
(3)如果25℃时,0.1mol·L-1的NaHSO4溶液中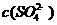 =0.029 mol·L-1,
=0.029 mol·L-1,
则0.1mol·L-1 H2SO4溶液中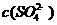 ________0.029 mol·L-1(填“<”、“>”或“=”)。
________0.029 mol·L-1(填“<”、“>”或“=”)。
(4)0.1mol·L-1 NaHSO4溶液中各种离子浓度由大到小的顺序是: 。
(5)如果25℃时,0.1mol·L-1 H2SO4溶液的pH=-lg0.11, 25℃时,0.10mol·L-1的H2SO4溶液中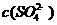 =________________。
=________________。
17.(12分)实验室里有一瓶混有NaCl的NaOH固体试剂,经测定其中NaOH的质量分数约为82.0%;为了验证其纯度,用浓度为0.2 mol·L-1的盐酸进行滴定,试回答下列问题:
(1)用托盘天平称量5.0g 固体试剂,用蒸馏水溶解且配成500ml溶液。
(2)将标准盐酸装入25.00ml 滴定管中。调节液面位置在 处,并记下刻度。
(3)取20.00ml待测液。该项操作使用的主要仪器有 ,用酚酞作指示剂时滴定到溶液颜色由 刚好变至 时为止。
(4)滴定达终点后,记下用去盐酸20.00ml,则试样中NaOH的质量分数为 。
(5)试分析滴定误差可能由以下哪些实验所引起? 。
A.转移待测液至容量瓶,未洗涤烧杯B.酸式滴定管用蒸馏水洗涤后,直接装盐酸溶液
C.滴定时,反应容器振动太剧烈,有液体溅出D.滴定终点时,滴定管尖嘴有气泡
E.滴定管读数开始时俯视,终点时仰视
16.已知热化学方程式:
C(s,金刚石)+O2(g)=CO2(g) △H1
C(s,石墨)+O2(g)=CO2(g) △H2
C(s,石墨)=C(s,金刚石) △H3=+1.9kJ/mol
下列说法正确的是( )
A.石墨转化成金刚石的反应是吸热反应
B.金刚石比石墨稳定
C.△H3=△H1-△H2
D.△H1>△H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com