
题目列表(包括答案和解析)
6.下列溶液,一定呈中性的是( )
A. c(H+)=1×10-7mol/L的溶液 B. pH=pOH 的溶液 C. pH=14-pOH 的溶液
D. 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
5.有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A. a mL B.(50―a)mL C. 大于(50―a)mL D. 大于a mL
4.下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应都不需要加热就能发生
C.吸热反应在一定条件(如常温、加热等)也能发生
D.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
3.强酸和强碱的稀溶液中和热可表示为:
H+(aq) + OH-(aq)= H2O(l) ΔH=-57.3kJ/mol以下4个化学方程式中,
①H2SO4(aq)+2NaOH(aq)==Na2SO4(aq)+2H2O(l) ②H2SO4(aq)+Ba(OH)2(aq)==BaSO4(aq)+2H2O(l)
③NH3·H2O(aq)+HCl==NH4Cl(aq)+H2O(l) ④NH3·H2O(aq)+CH3COOH(aq)==CH3COONH4(aq)+H2O(l)
其中反应热为57.3kJ/mol的是( )
A.①② B.③ C.④ D.均不符合
2.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
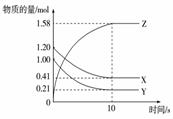 下列描述正确的是( )
下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g) Z(g)
Z(g)
1.氨水中所含有的分子和离子有( )
①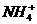 ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
22、(6分)95℃时水的离子积为1×10-12,在该温度下将pH=8的Ba(OH)2溶液与PH=4的 稀硫酸溶液混合,欲使混合溶液的pH=7,则Ba(OH)2溶液与H2SO4溶液的体积比为多少?(假设二者混合后的体积为二者体积之和)
荆州中学2010-2011学年度上学期
20、(10分)在一个温度恒定的密闭容器中,发生反应2SO2+O2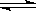 2SO3,请按要求回答下列问题.
2SO3,请按要求回答下列问题.
[恒定压强条件下]
(1)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成0.9 mol SO3,这时SO2的转化率为________.
(2)若开始时放入4 mol SO2和2 mol O2,达平衡后,生成SO3的物质的量为________。
[恒定容积条件下]
(3)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成a mol SO3,则a________0.9(填“>”、“<”或“=”).
(4)若令x、y和z分别代表初始加入SO2、O2和SO3的物质的量,要使达平衡时,反应混合物中三种气体的物质的量分别与(3)中平衡时完全相同,且反应正向进行,则必须满足的等式关系是______________________.(用x、y、z代数式表示),x的取值范围是 。 21、(10分)实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
(1)碳酸钠溶液呈明显的碱性,主要原因是(用离子方程式表示) 。
当用热水溶解时碱性更强是因为 。
(2)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4-5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。终点颜色变化是 。
(3)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为 mol/L。
(4)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为C2 mol/L。在下述情况下,C1与C2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则C1 C2
②当Na2CO3中含有NaOH时,则C1 C2
19、(10分)已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系: ①c(Cl一)>c(NH4+)> c(H+)> c(OH-)
②c(Cl一) >c(NH4+)> c(OH-)> c(H+) ③c(NH4+)>c(Cl一)> c(OH-)> c(H+)
④ c(Cl一) >c(H+)> c(NH4+)> c(OH-) 填写下列空白: (1)由若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序符合___________(填序号) (2)若溶解两种溶质,上述关系中③是正确的,则溶液中的溶质为________ ____________; 若溶解两种溶质,上述关系中④是正确的,则溶液中的溶质为____________________。 (3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于” 下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____________ c(OH-)。
18、(10分)已知化学反应①:Fe(s)+CO2(g) 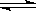 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
|
温度 |
K1 |
K2 |
|
973 K |
1.47 |
2.38 |
|
1173 K |
2.15 |
1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)  CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=
.
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=
.
(3)在相同温度下,根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号,下同).
A.增大压强 B.体积不变时充入稀有气体 C.升高温度
D.使用合适的催化剂 E.在体系中投入少量P2O5固体
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:①图甲中t2时刻发生改变的条件可能是________________.
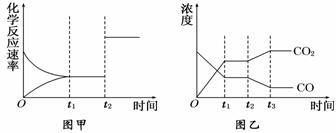 ②图乙中t2时刻发生改变的条件可能是
.
②图乙中t2时刻发生改变的条件可能是
.
A.升高温度 B.降低温度 C.加入催化剂 D.增大压强
E.减小压强 F.充入CO2 G.分离出部分CO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com