
题目列表(包括答案和解析)
22.(9分)(1) ; ; 。
(2) 种。
(3) , 。
(4) 。
(5) 和 。
21.(6分)(1) mL;(2) mL;(3) mL。
27. (6分)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B. 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗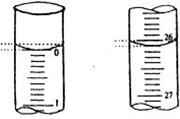 净后没有干燥
净后没有干燥
C. 酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
|
(3)某学生根据三次实验分别记录有关数据如下:
|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。(准确到小数点后四位)

 遂宁一中高2012级第三学期半期考试化学答卷
遂宁一中高2012级第三学期半期考试化学答卷
26.(9分)按图所表示的装置进行实验:
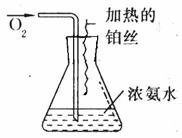
(1)实验开始一段时间后,可观察到锥形瓶口上方有白烟生成,请将可能观察到的其他现象补齐__ _______.有关化学方程式为_________ 。(提示:有四个方程式。)
(2)由于气温的原因,上述实验一段时间后现象不太明显,应该向锥形瓶内加入下列哪种物质才能看到明显的现象________(填字母)。
A.NaOH固体或生石灰 B.浓H2SO4 C.NH4Cl固体
(3)经过对比试验证明。在其他条件相同时,用空气代替氧气的实验效果较差,主要原因是 __________________。
25.B[平行班做] (6分)(1)磷在自然界里主要以 的形式存在于矿石中。磷的单质有多种同素异形体,其中最常见的是有毒的 和无毒的 。
(2)磷在过量的氯气中燃烧的化学方程式是: 。
(3)磷在空气中燃烧生成的氧化物通常可用作强干燥剂。制备100g这种干燥剂所消耗的空气的体积约为 L(在标准状况下空气中VN2:VO2=4:1)。
24.B[平行班做](9分)(1)下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性。
K 2CO3 , 溶液呈 性;
Na2SO4 , 溶液呈 性;
CuCl2 , 溶液呈 性。
(2)把AlCl3 溶液蒸干后再灼烧,最后得到的主要固体产物是 ,其理由是(用化学方程式表示,并配以必要的文字说明)_______________ _ 。
25A.[1、5、6班做](6分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为__________L, NO2的体积为_________L。
(2)待产生的气体完全释放后,向溶液中加入V mLamol/L 的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______mol·L-1(用a、V表示)
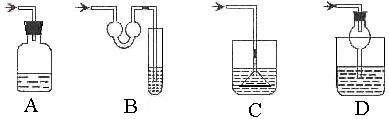
(3)以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )
23. (7分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 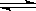 2SO3(g)(正反应放热),反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热),反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
(1)降低温度,SO2的转化率_________,化学反应速率_________。(填“增大”“减小”或“不变”)
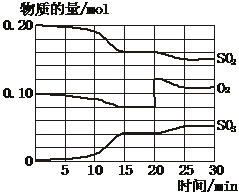 (2)反应处于平衡状态的时间是_________。
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
24A.[1、5、6班做](9分)
(1)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比 _________。
(2)将标准状况下的4.48 L氨气完全溶解在含0.1 mol HCl的水溶液中形成1 L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是 。
(3)常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性,生成的盐化学式为_____________________。AOH与HnB完全中和所得溶液呈_________性,其原因用离子方程式表示为__________________________。
22.(9分)常温下,将0.01 mol的NH4Cl和0.002 mol NaOH溶于水配成1L溶液。
(1)该溶液中存在的平衡体有: ; ; 。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4)物质的量之和是0.01 mol的三种微粒是: 。
(5) 和 两种微粒的物质的量之和比OH-多0.008 mol。
21.(6分)有PH=12的氢氧化钠溶液100mL,若要使其变为11,试回答
(1)若加蒸馏水,需要加 mL;(混合时溶液体积变化忽略不计,下同)
(2)若加入PH=10的氢氧化钠溶液,应加入 mL;
(3)若加入0.008mol/LHCl溶液应加入 mL。
20. 在一定温度下,把2.0体积的N2和6.0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2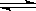 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
A. 1.0体积的N2和3.0体积的H2
B. 2.0体积的N2、6.0体积的H2和4.0体积的NH3
C. 4.0体积的NH3和1.0体积的H2
D. 2.0体积的NH3
第Ⅱ卷(非选择题 共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com