
题目列表(包括答案和解析)
22.(1)a电极材料应为 。
(2)电解液c可以是(填编号) 。
(3)d为苯,其作用为_______________________________。
21.⑴ 钢铁在较强的酸性溶液中腐蚀时,正极的电极反应式为 。
钢铁在中性溶液中腐蚀时,正极的电极反应式为 。
⑵ 铁为 极。
27.有一硝酸盐晶体,其化学式为M(NO3)x·3H2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。求:
(1)金属M的相对原子质量= ,x= 。
(2)电解后溶液的pH= (电解过程中溶液体积变化忽略不计)。


 答题卷(请按要求写好姓名,班级和考号,只交答题卷)
答题卷(请按要求写好姓名,班级和考号,只交答题卷)
26.某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器如下图所示,回答下列问题:
(1)电解的离子方程式为 。
(2)下列实验操作中必要的是 (填写字母)。
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(3)铜的相对原子质量为 (用带有m、V的计算式表示)。
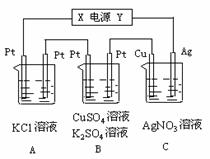
2.16g,B中一根Pt电极质量增加0.32g,且此时B中
两极都有气体产生。试回答:
⑴ 电源电极X名称为____________。
⑵ C池中的pH变化________(填“增大”、“减小”
或“不变”)。
⑶ 写出A池中所发生的化学反应方程式:
____________________________________________
⑷ 计算B池中产生的气体在标准状况下的总体积是 L。
25.如图所示,若电解5min时铜电极的质量增加
24.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上常采用下列反应合成甲醇:CO(g) + 2H2(g)
 CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ;ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ;ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ;ΔH = -44.0 kJ/mol
 请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 kJ。
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 kJ。
23.下列有关实验操作或对实验事实的叙述正确的是 (填序号)。
①用25mL碱式滴定管量取24.00mLKMnO4溶液;
②蒸干并灼烧MgCl2溶液可得纯净的无水氯化镁;
③为了使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒;
④用标准浓度的盐酸滴定未知浓度的氢氧化钠溶液,读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,会使结果的数值偏低
⑤中和热的测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液与用60mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应相比,后者所求出的中和热数值大于前者。
22.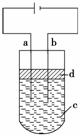 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得
白色、纯净的Fe(OH)2沉淀,应用右图所示电解实验可制得白色、纯净的
Fe(OH)2沉淀,两电极的材料分别为石墨和铁。
(1)a电极材料应为 。
(2)电解液c可以是(填编号) 。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_______________________________。
21.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重。
⑴ 钢铁在较强的酸性溶液中腐蚀时,正极的电极反应式为 。
钢铁在中性溶液中腐蚀时,正极的电极反应式为 。
⑵ 如果在铁的表面镀上一层锌,就可以防止铁生锈,则在电镀过程中铁为 极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com