
题目列表(包括答案和解析)
1.下列说法正确的是( )
A.根据能量守恒定律,反应物的总能量一定等于生成物的总能量
B.粗铜精炼时,与电源负极相连的是粗铜
C.在海轮外壳连接锌块保护外壳不受腐蚀
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源
20.一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g) +3B(g) xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,已知2min内用C物质的浓度变化量表示的平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知反应速率v(B) : v(C)=3 : 2 ,试计算:
xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,已知2min内用C物质的浓度变化量表示的平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知反应速率v(B) : v(C)=3 : 2 ,试计算:
(1)x、y的值分别分别是 和
(2)平衡时反应物A的转化率
(3)平衡常数K= (可以用分数表示)
2010-2011学年度第一学期教学质量检查
19.(8分)室温下,有下列四种溶液,根据题目要求填空(溶液体积变化忽略不计)
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
|
pH |
11 |
11 |
3 |
3 |
(1)在①中加入氯化铵固体,溶液的pH变化是: (填增大、减小或不变)。
(2)分别将等体积的③和④加水稀释100倍,所得溶液的pH:③ ④(填>、=或<)。(3)②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO一) c(Na+)(填>、=或<)。
(4)①、④两溶液等体积混合,所得溶液呈 性(填“酸”、“碱”或“中”)。
18.(8分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)已知升高温度,NO2的浓度减小,则该反应是 热反应。
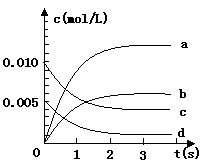 (2)右
(2)右 图中表示NO2的变化的曲线是
图中表示NO2的变化的曲线是
用O2表示从0-2 s内该反应的平均速率v =
(3)为使该反应的反应速率增大,
且平衡向正反应方向移动的是
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
17.(本题包括两小题,共8分)
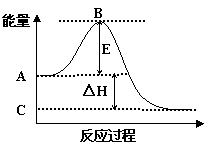 (1)(4分)2SO2(g)+O2(g)
(1)(4分)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ/mol。
请回答下列问题:
 ①图中A点表示:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。
 ②图中△H= kJ/mol。
②图中△H= kJ/mol。
(2)(4分)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1
mol水蒸气转化为液态水放热45kJ,则反应H2(g) +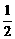 O2(g) = H2O( l )的
O2(g) = H2O( l )的
ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
16. (12分)如图,外接电源为Zn-MnO2干电池,甲、乙为相互串联的两个电解池,请回答:
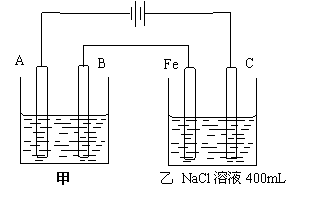
(1)甲池若为用电解原理精炼铜的装置, B电极是 极,材料是
A电极反应式为 ,电解质溶液可以是
(2)乙池中Fe极是 极,若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色
若C电极材料为石墨,C电极反应式为
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。该电池的负极材料是 ,电极反应式为
。

15.(12分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
 (1)以上操作步骤中有一步有错误,请指出编号
,该错误操作会导致测定结果
(1)以上操作步骤中有一步有错误,请指出编号
,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 中。
(从下图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是: (填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟之内不再改变。
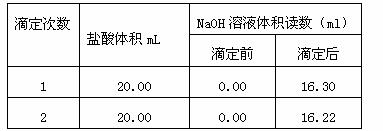 (5)以下是实验数据记录表
(5)以下是实验数据记录表
通过计算可得,该盐酸浓度为: mol·L-1(计算结果保留4位小数)。
14.在氯化铵溶液中,下列关系正确的是
A.c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ) B.c(NH4+)>c(Clˉ)>c(H+)>c(OHˉ)
C.c(NH4+)+c(H+)=c(Clˉ) +c(OHˉ) D.c(NH4+)=c(Clˉ)>c(OHˉ)>c(H+)
第Ⅱ卷(非选择题共54分)
13.常温下,下列各组离子一定能大量共存的是
A.Na+、K+、Cl-、CH3COO- B.Ba2+、K+、SO42-、CO32-
C.Al3+、K+、CO32-、Cl- D. Na+、Fe3+、Cl-、SO42-
12.下列热化学方程式正确的是(注: 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g) △H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+ HCl(aq)= NaCl(aq)+ H2O(l) △H=-57.3kJ/mol(中和热)
C.S(s)+ O2(g)= SO2(g) △H= -269.8kJ/mol(反应热)
D.2NO2 = O2 + 2NO △H= +116.2kJ/mol(反应热)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com