
题目列表(包括答案和解析)
5.电解饱和食盐水,当阴极附近有0.8molNaOH生成时,导线中通过电子的物质的量是( )
A.0.16mol B. 0.2mol C. 0.4mol D.0.8 mol
4.电解CuCl2和NaCl的混合溶液,阴极和阳极上分别析出的物质是( )
A.H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
3.把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是( )
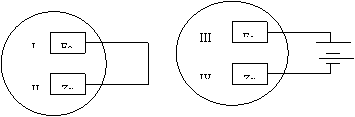
A.I和III B.I和IV C.II和III D.II和IV
2.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为( )
A.C + H2O == CO + H2 ; ΔH== +131.3KJ·mol-
B. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +10.94KJ·mol-
C. C(s)+ H2O(l) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol-
D. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol-
1.未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
① 天然气②煤③核能④水电⑤太阳能⑥燃料电池⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外
21.有一硫酸和硝酸的混合溶液,取出20 mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32 g;滤液与4 mol/L的NaOH溶液35 mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度?
(2)另取20mL原溶液,加入3.2 g铜粉共热,生成气体一氧化氮的体积(标准状况)?
南充高中2012级第三学期第一次阶段性考试
20.(11分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
优等品 一等品 合格品
外观 白色结晶,无可见机械杂质 无可见机械杂质
氮(N)含量 ≥21.0% ≥21.0% ≥20.5%
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
观察外观:该硫酸铵化肥无可见机械性杂质。
实验探究:按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:
_____________________________________,烧杯中盛放
的试剂最好是__________(填“浓硫酸、稀硫酸或水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
。
问题讨论 :
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是 ;乙同学:实验装置中还存在另一个明显缺陷是 ______。经过大家充分讨论一致认为:针对甲、乙两 位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
探究结论:称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是或不是”)一等品。
19.(8分)已知Mg和稀HNO3反应,还原产物是N2O;若HNO3极稀,则还原产物为NH3,并与过量HNO3反应生成NH4NO3。现有9.6 g Mg与1 L 1.1 mol/L的稀 HNO3(过量)充分反应后收集到a mL气体(标准状况),同时测得c(NH4+)=0.08mol/L(设反应前后溶液体积不变)。求:
(1)a= ; (2)有 mol HNO3被还原;
(3)反应后溶液的c(H+)= mol/L; (4)反应后溶液中c(NO3-)= mol/L。
18.(12分)铜既能与稀硝酸反应.也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu + HNO3 - Cu(NO3)2 + NO↑+NO2↑+ H2O(未配平)。
(1)硝酸在该反应中的作用是__________________,该反应的还原产物是____________。
(2)0.3 mol Cu被硝酸完全溶解后,Cu失去的电子数是___________,如果得到的NO和 NO2物质的量相同,则参加反应的硝酸的物质的量是____________,若用排水法收集这些气体,可得标准状况下的气体体积____________。
(3)如果参加反应的Cu与HNO3的物质的量之比是5︰1 4,写出并配平该反应的离子方程式____________________________________________________。
17.(10分)已知下列离子或物质的氧化性强弱顺序是:ClO3->BrO3->Cl2>IO3-。回答下列问题:
(1)反应Cl2 + I2 + H2O→HCl + HIO3能否发生? (填“能或不能”)。
(2)现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
①开始滴入时可观察到的现象是 ,发生反应的离子方程式_________________________________________________。
②继续滴加氯水直至过量,又可观察到的现象是 _,发生反应的化学方程式为:__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com