
题目列表(包括答案和解析)
21、汽车的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2 + Pb + 2H2SO4 = 2PbSO4↓ + 2H2O,根据此反应判断下列叙述中正确的是
A、PbO2是电池的负极 B、负极的电极反应式为:Pb + SO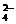 – 2e – = PbSO4↓
– 2e – = PbSO4↓
C、PbO2得电子,被氧化 D、电池放电时,溶液酸性增强
20、一定温度下,可逆反应A2(g)+3B2(g) 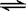 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A、容器内每减少1mol A2,同时生成2mol AB3
B、容器内每减少1mol A2,同时生成3mol B2
C、单位时间内反应物减少的分子数等于生成物增加的分子数
D、容器内A2、B2、AB3的物质的量浓度之比为1:1:1
19、汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A、反应达到平衡后,NO的反应速率保持恒定
B、使用高效催化剂可有效提高该反应的正、逆反应速率
C、升高温度可使该反应的逆反应速率降低
D、单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
18、发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生N2和水
蒸气。已知:N2(g) + 2O2(g) = 2NO2(g);△H = + 67.7kJ/mol。
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H = – 534kJ/mol。
下列关于肼和NO2反应的热化学方程式中,正确的是
A、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C、N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol。
17、一定温度下的恒容容器中,能标志某可逆反应A(s)+2B(g) C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
A、混合气体的压强不随时间变化而变化 B、气体总物质的量不随时间变化而变化
C、2 v (B)正=v (D)逆 D、单位时间内消耗n mol C,同时消耗2nmol B
16、下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+1/2O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+1/2O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A、① B、④ C、②③④ D、①②③
15、有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A、A>B>E>D B、A>B>D>E C、D>E>A>B D、D>A>B>E
14、下列叙述正确的是
A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
D、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
13、化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A、钢铁的腐蚀过程绝大多数都是电化学腐蚀
B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C、电解MgCl2饱和溶液,可制得金属镁
D、电解CuCl2饱和溶液,生成金属铜和氯气
12、“暖宝宝”的主要原料有:铁粉、活性炭、水、食盐等。其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液。下列有关“暖宝宝”的说法中错误的是
A、活性炭作用是作原电池的正极,加速铁粉的氧化
B、“暖宝宝”放出的热量是铁氧化时产生的
C、“暖宝宝”使用前要密封保存,使之与空气隔绝
D、活性炭最终将转化为二氧化碳
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com