
题目列表(包括答案和解析)
2、钢铁在潮湿的空气中往往因电化学过程而被腐蚀,下列方程式在钢铁的电化学腐蚀过程中不存在的是:
A、Fe-2e- Fe2+ B、2H2O+O2+4e- 4OH-
C、2Fe+2H2O+O2 2Fe2++4OH- D、Fe-3e- Fe3+
1、以下说法中正确的是
A、△H<0的反应均是自发反应 B、△S为负值的反应均不能自发进行
C、冰在室温下自动熔化成水,是熵增的重要结果 D、高锰酸钾加热分解是一个熵减小的过程
21、(12分)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
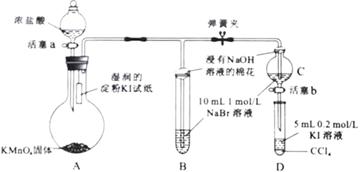 实验过程:
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
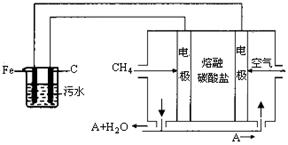 22、(14分)电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇去)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如图所示。
22、(14分)电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇去)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如图所示。
(1)通空气的这一极是 极(填“正”或“负”),C这一极是 极(填“阴”或“阳”)。
(2)图中熔融碳酸盐中碳酸根离子的定向移动方向是 (填“向左”或“向右”)。实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(3)电解池阳极的电极反应分别是① ;
②4OH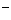 -4e
-4e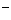 ===2H2O+O2↑。
===2H2O+O2↑。
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应式是CH4+4CO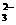 -8e
-8e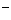 ===5CO2+2H2O。
===5CO2+2H2O。
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
第一节 实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
上饶县中学高二年级第一次月考
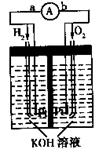
20、(10分)氢氧燃料电池是符合绿色化学理念的新型发电装置。右下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I. 2Li+H2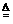 2LiH
2LiH
II. LiH+H2O===LiOH+H2↑
①反应I中的还原剂是 。
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
19、(10分)下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
(1)其中标出仪器使用温度的是 (填编号)。
(2)实验时用来精确量取液体体积的是 (填编号)。
(3)使用前要检查仪器是否漏液的是 (填编号)。
(4)由于操作错误,使得到的数据比正确数据偏小的是 (填编号)。
A.实验室制乙烯测量混合温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面的读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
 (5)称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为
g。
(5)称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为
g。
18、下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-===4OH-
D.工业上电解饱和食盐水的阳极反应:2Cl- -2e-===Cl2↑
15、利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
A.电解时以精铜作阳极
B.电解时阳极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu===Cu2++2e-
D.精铜连接电源负极,其电极反应是Cu2++2e-===Cu
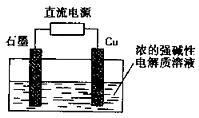 16、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O
16、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
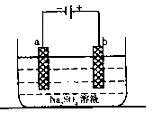 17、右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是
17、右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
14、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化成氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应式为
A.H2+2OH-===2H2O+2e- B.O2+4H++4e-===2H2O
C.H2===2H++2e- D.O2+2H2O+4e-===4OH-
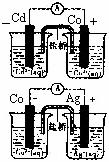
13、根据右图,可判断出下列离子方程式中错误的是
A.2Ag(s)+Cd2+(aq)=== 2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq)
11、下列对某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO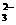
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不溶解,一定有CO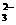
C.加入氢氧化钠并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH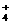
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀不溶解,一定有Ba2+
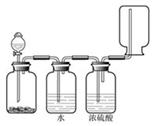 12、右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
12、右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
A.锌和盐酸生成氢气
B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com