
题目列表(包括答案和解析)
41.关于CuSO4溶液和Fe(OH)3胶体描述正确的是
A.两者都能产生丁达尔现象 B.两者都不能产生丁达尔现象
C.CuSO4溶液能产生丁达尔现象,Fe(OH)3胶体不能产生丁达尔现象
D.CuSO4溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象
22.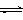 (21分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) △H﹥0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
(21分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) △H﹥0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
⑴该反应的平衡常数表达式K= 。
⑵下列措施中能使平衡时K增大的是 填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.降低温度
⑶8分钟内,CO的平均反应速率V(CO)= mol/(L·min)。
⑷1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
|
容器 |
甲 |
乙 |
|
反应物投入量 |
3mol Fe、2mol CO2 |
4mol FeO、3mol CO |
CO的浓度(mol·L ) ) |
C1 |
C 2 |
|
CO2的的体积分数 |
φ1 |
φ2 |
|
体系压强(Pa) |
p1 |
p2 |
|
气态反应物的转化率 |
α1 |
α2 |
①下列说法正确的是 。
A.2C1 =3C 2 B.φ1 =φ2 C.p1 <p2 D.α1=α2
②求C1、φ1、α2
过程:
 江苏省盐城中学2010-2011学年度第二学期期中考试
江苏省盐城中学2010-2011学年度第二学期期中考试
21.(14分)用中和滴定法测定某烧碱的纯度
(1)配制待测液:将2.0g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要的玻璃仪器有 (任填两种)。
(2)滴定:
①盛装0.20mol·L-1盐酸标准液应该用 式滴定管。
②滴定时,应先向锥形瓶中加1-2滴 作为指示剂。
③有关数据的记录如下:
|
滴定序号 |
待测液体体积(mL) |
所耗盐酸标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
25.80 |
|
3 |
20.00 |
1.20 |
21.20 |
|
4 |
20.00 |
2.00 |
34.00 |
(3)纯度计算:烧碱样品的纯度为 。
(4)对几种假定情况的讨论:(填“偏大”“不变”或“偏小”)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果 。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外则会使测定结果 。
③滴定终了仰视读数,则会是测定结果 。
20.(12分)称取三份锌粉,分别盛在三只锥形瓶中,按下列要求另加物质后,塞上带导管的塞子,测定生成H2的体积。锥形瓶甲中加入2 mol/L的盐酸10mL,乙中加入2 mol/L的醋酸10mL,丙中加入2 mol/L的醋酸10mL及少量CuSO4粉末。若反应终了,生成H2体积相同,且锌没有剩余。请在小题⑴、⑵中用>、=或<回答:
(1)反应刚开始时甲、乙和丙中反应速率V的大小关系为 。
(2)三只锥形瓶中参加反应的锌的质量m大小关系为 。
(3)简要说明在反应过程中乙、丙中反应的速率不同的理由是 。
(4)为了加快甲反应产生H2的速率采取的下列措施可行的是 。
A.升高温度 B.加入浓硝酸 C.加入醋酸钠晶体 D.加入氯化钠晶体
19.(15分)(1)25℃时,某NaCl溶液中c(Cl-)=1×10-4 mol/L,则该溶液中c(Na+)∶c(OH-)= 。
(2)常温下,将0.1 mol/L NaOH溶液与0.06mol/L的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③在此温度下,将pH=12的NaOH溶液VaL与pH=2的H2SO4溶液VbL混合,所得混合液为中性,则Va︰Vb= 。
18. (9分)反应m A+n B pC在某温度下达到平衡。
(9分)反应m A+n B pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______(“正”或“逆”)方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
17.(8分)今有①NH3·H2O;②NaOH;③Ba(OH)2三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①>②=③
E.①=③>② F.①<②=③ G.①=②<③ H.①=②>③
(1)请写出NH3·H2O的电离方程式 。
(2)当它们的物质的量浓度相同时,其pH的关系是 。
(3)当它们pH相同时,其溶液中水的电离程度 。
(4)中和等体积、等物质的量浓度的三种碱溶液,需同物质的量浓度的盐酸溶液的体积关系为 。
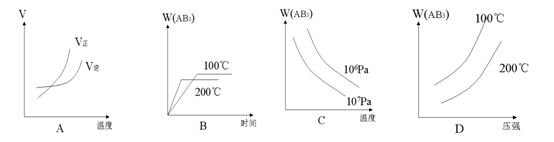
16. 对于可逆反应,A2(g)+3B2(g) 2AB3(g) △H<0下列图像正确的是
对于可逆反应,A2(g)+3B2(g) 2AB3(g) △H<0下列图像正确的是
Ⅱ 非选择题(共79分)
15.对于常温下pH为1的硝酸溶液,下列叙述正确的是
 A.该溶液中存在硝酸分子
A.该溶液中存在硝酸分子
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的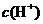 与水电离出的
与水电离出的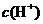 之比值为10-10
之比值为10-10
 D.该溶液中水电离出的
D.该溶液中水电离出的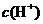 是pH为3的硝酸中水电离出的C(H+)的100倍
是pH为3的硝酸中水电离出的C(H+)的100倍
14.25℃时,水的电离达到平衡:H2O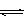 H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡向左移动,c(OH―)降低
B.向水中加入少量的水,平衡向右移动,c(H+)增大
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,c(H+)和c(OH-)增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com