
题目列表(包括答案和解析)
7、在蒸发皿中加热蒸干下列溶液后再充分灼烧(低于400℃),可得该物质固体的是
A.氯化铝 B.小苏打 C.硫酸镁 D.亚硫酸钠
6、 水中存在平衡:2H2O H3O+
+ OH-,欲使该平衡正移且溶液酸性增强,可加入
水中存在平衡:2H2O H3O+
+ OH-,欲使该平衡正移且溶液酸性增强,可加入
A.NH4Cl(s) B.H2SO4溶液 C.NaHCO3(s) D.SO3
5、对反应Ag+ + Cl- = AgCl↓,下列说法正确的是
A.该反应属于化合反应 B.该反应仍有一定的可逆性
C.当Ag+和Cl-物质的量相等时,溶液中Ag+和Cl-可完全被消耗而无任何剩余
D.该反应能自发发生,可用作原电池反应
4、一定条件下进行反应 2X(g)+Y(g) Z(s)+3W(g) △H<0。达到平衡后,t1时刻改变某一条件所得v-t图像如图,则改变的条件为
Z(s)+3W(g) △H<0。达到平衡后,t1时刻改变某一条件所得v-t图像如图,则改变的条件为
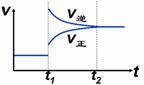 A.增大压强 B.升高温度
A.增大压强 B.升高温度
C.加催化剂 D.增加生成物浓度
3、下列物质中,其水溶液能导电,但既不是电解质又不是非电解质的是
A.Na2O2 B.NH3 C.CH3COONH4 D.Cl2
2. 下列说法中不正确的是
A.对于任何化学反应来说,反应速率越大,反应现象就越明显
B.在其它条件不变时,升高温度一定会加快化学反应的反应速率
C.使用合理的催化剂,可以改变化学反应速率,但不能改变化学平衡状态
D.增大反应物浓度,可使单位体积内活化分子数增加,反应速率加快
1. 下列各组物质的颜色变化,可用勒夏特列原理解释的是
A.压缩H2与I2(g)反应的平衡混合气体,颜色变深
B.向盛有NO2的集气瓶中投入活性炭,颜色变浅
C.蔗糖中滴入浓硫酸会变黑
D.光照氯水,颜色变浅
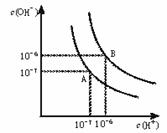
21.(1)水的电离平衡曲线如下图所示。
若以A点表示25℃时水在电离平衡时的离子浓 度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ;将1000C时pH=8的Ba(OH)2溶液与1000C时pH=5的稀盐酸混合,欲使混合溶液pH=6,则Ba(OH)2与盐酸的体积比为 。
(2)在温度为830
K时,在容积为1L的容器中进行下列可逆反应:CO(g)
+ H2O(g)  H2(g)
+ CO2(g)
H2(g)
+ CO2(g)
①若起始时加入CO为2mol、H2O 为3mol,反应达平衡时,H2为 1.2mol;再将容器体积缩小到0. 5L,则此时H2的物质的量为 ;
②830 K时,起始加入CO为 a mol,H2O 为 b mol,反应达平衡时H2为c mol,当a=b时,则c/a= 。
20、(1)有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者由大到小关系为 。
(2)已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2,NaCN+HF==HCN+NaF,
NaNO2+HF==HNO2+NaF,HF的电离常数是 (填序号①、②或③,下同); HNO2的电离常数是 ;HCN的电离常数是 。
 (3)有A、B、C三种气体,若起始时取1
mol A与2 mol B,发生反应A+2B
(3)有A、B、C三种气体,若起始时取1
mol A与2 mol B,发生反应A+2B 2C.达到平衡时c(A)、c(B)、c(C)之比与反应速率v(A)、v(B)、v(C)之比恰好相同,则A的平衡转化率为 ;
2C.达到平衡时c(A)、c(B)、c(C)之比与反应速率v(A)、v(B)、v(C)之比恰好相同,则A的平衡转化率为 ;
19.现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填“>”“=”“<”);
(2)若加入催化剂,平衡时气体混合物的总物质的量 (填“增大”“减小”或“不变”)。
(3)若B是有色物质,A、C均无色,平衡后加入C(体积不变)时混合物颜色
(填“变深”“变浅”或“不变”,下同);而维持容器内压强不变,充入氖气时,混合物颜色 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com